调节性T细胞(Tregs)经常对抗肿瘤免疫构成挑战,但它们如何抑制免疫反应尚未完全理解。在对Tregs在肿瘤中的积累和激活进行研究时,Moreno Ayala等人发现CXCR3+ Tregs在肿瘤中更倾向于与CXCL9+ DC1细胞相互作用,并且在Tregs中特异性基因敲除CXCR3增强了DC1细胞对肿瘤抗原的交叉呈递、对CD8+ T细胞的激活以及抗肿瘤免疫。他们的研究结果最近发表在《Immunity》杂志上。
Moreno Ayala等人首先研究了携带MC38结肠癌、EL4胸腺淋巴瘤或9464D神经母细胞瘤的小鼠中的T细胞表型。尽管Tregs和CD8+ T细胞的频率在不同肿瘤中存在差异,但两种细胞群体之间始终存在正相关性。研究人员还注意到,与健康组织和外周淋巴结相比,CXCR3在肿瘤和引流淋巴结中的CD8+ T细胞、效应性CD4+ T细胞和Tregs上的表达增加。
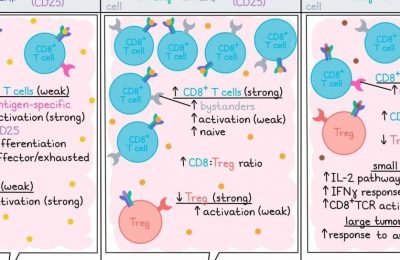
动力学评估显示,Tregs中CXCR3表达的峰值,与CXCR3+CD8+ T细胞对肿瘤的浸润有相关性,此时Tregs开始在引流淋巴结中积聚。在肿瘤浸润的高峰期,经历抗原刺激的(CD44+)CXCR3+ Tregs相对于CD44+CXCR3– Tregs表现出更高的激活标记物和效应功能(CD69、CD103、KLRG1、PD-1和CTLA-4)。综合这些结果表明,CXCR3的表达支持Tregs在肿瘤中的增加积累和激活。
为了专门研究CXCR3对Tregs的影响,Moreno Ayala等人利用雌性小鼠的X染色体失活生成了遗传学小鼠模型。在这些模型中,小鼠含有CXCR3+和CXCR3KO Tregs的异质群体,并可以通过给予白喉毒素来清除其中一种Treg群体(根据模型的不同)。在清除CXCR3+ Tregs的小鼠中(只剩下CXCR3KO Tregs),与保留CXCR3+ Tregs完整或清除CXCR3KO细胞的情况相比,MC38、EL4和9464D肿瘤的生长延迟。当清除一定比例的Tregs而不考虑CXCR3时,这种效应并未观察到,这表明CXCR3+ Tregs在特定抑制抗肿瘤效应中发挥着作用。
进一步研究发现,在CXCR3KO Tregs情况下,包括一群肿瘤抗原特异性CD8+ T细胞在内的CD8+ T细胞在MC38、EL4和9464D模型的肿瘤中增加。通过体外再刺激后检测IFNγ和TNFɑ的产生量发现,Tregs中的CXCR3缺陷并不影响CD8+ T细胞的活性,同样也没有影响PD-1的表达,这表明CXCR3+ Tregs限制了CD8+ T细胞的积累,但不影响其激活。此外,添加抗PD-1抗体可用于增强抗肿瘤效果。通过观察肿瘤中Treg的积累,研究人员注意到Treg的频率稍微降低并且与CXCR3缺乏呈相关性。在一个基因工程的肉瘤发生小鼠模型(非移植)中也观察到类似的效果,即在肉瘤形成后清除CXCR3+ T细胞导致肿瘤内CD8+ T细胞增加和Tregs减少。
观察CXCR3KO Tregs的特性,研究人员注意到在MC38肿瘤进展过程中,PD-1和CTLA-4的表达降低,表明其活化表型较弱。在同时存在CXCR3+和CXCR3KO Tregs的小鼠中进行直接竞争性测试时,与CXCR3+细胞相比,CXCR3KO Tregs在肿瘤和引流淋巴结中所占的Tregs比例较小,并且表达的PD-1和CTLA-4较少,再次表明CXCR3有助于肿瘤组织中Treg的优先积累和激活。更进一步,研究人员通过过继性地转移体外激活和分化的表达或不表达CXCR3的Th1样Tbet+ Treg,随后检测了CXCR3+ Treg的积累。在转移到MC38肿瘤小鼠后,与WT Tregs相比,CXCR3KO Tregs在引流淋巴结中富集,但在肿瘤中减少,这表明CXCR3表达本身对于Treg在肿瘤中的累积至关重要。
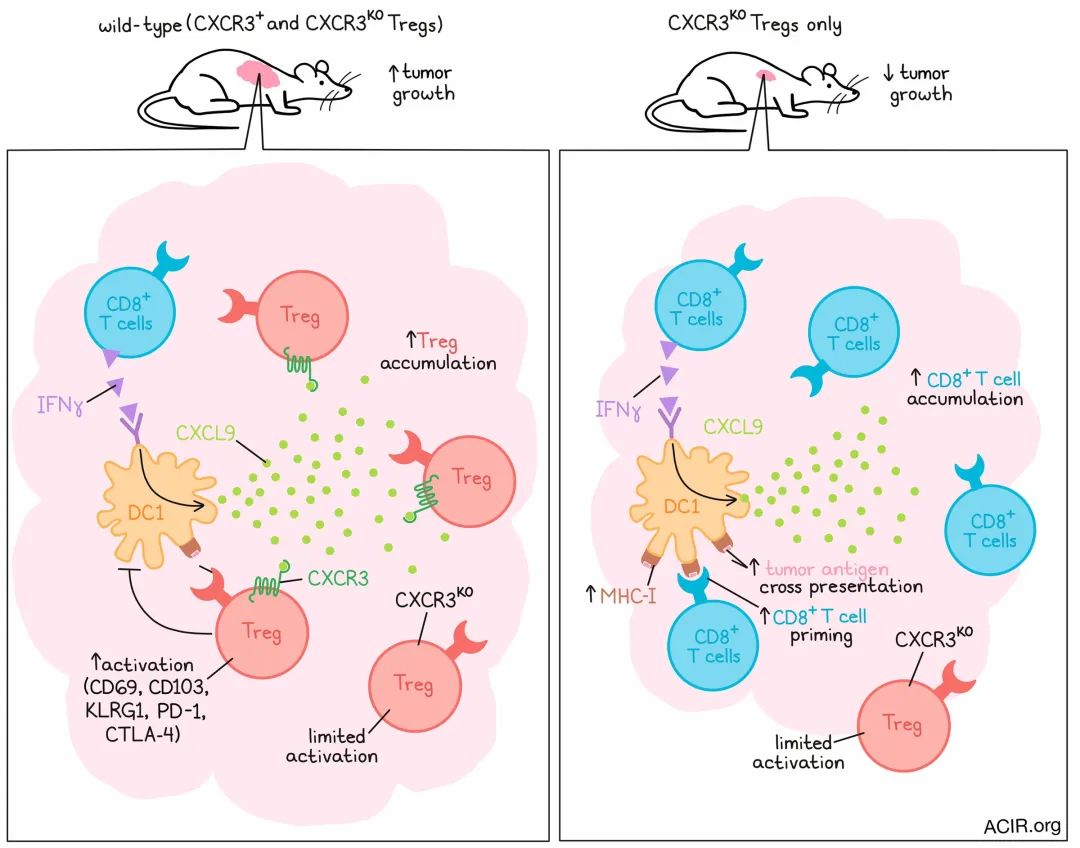
接下来,研究人员假设Tregs中的CXCR3可能通过促进Treg与DC的共定位和调节来发挥作用,已知在C57BL/6小鼠中,DC产生CXCR3配体CXCL9和CXCL10。为了研究这一点,研究人员开发了一种带有荧光标记的小鼠模型,使他们能够可视化和量化Tregs与CD11c+ DC以及CD8+ T细胞与DC之间的相互作用。结果显示,CXCR3缺陷的Treg与DC相互作用的可能性低于CXCR3正常的Treg,而当Treg缺乏CXCR3时,CD8+ T细胞增加并更可能与DC相互作用。在同时存在CXCR3+和CXCR3KO细胞的竞争性环境中,Treg与DC之间的相互作用的结果类似,但对CD8与DC之间的相互作用的影响被逆转了。
研究人员观察了CXCL9和CXCL10的产生情况,发现CXCL9几乎完全由DC产生,而CXCL9+CD11c+细胞的数量与野生型Tregs的数量呈正相关。当Tregs中敲除CXCR3时,这种正相关性较弱,并且在CXCL10中没有观察到这种现象,因为CXCL10的产生不仅限于DC。在缺乏CD8+ T细胞或IFNγ的情况下,CXCL9减少,这支持了一种假设,即CD8+ T细胞产生的IFNγ可能有助于DC上调CXCL9的表达,从而吸引CXCR3+ Tregs。通过过继转移实验进一步支持了这一假设,结果显示在缺乏DC1的小鼠中,CXCR3+ Tregs在肿瘤中累积增多的现象消失了。
最后,研究人员假设CXCR3+ Treg细胞可能调节DC1激活抗肿瘤CD8+ T细胞反应的能力,使用表达OVA的MHC-I缺陷的MC38肿瘤来测试他们的假设,这使得研究人员能够测量CD8+ T细胞对DC交叉呈递的反应。结果显示,在CXCR3KO Tregs的背景下,肿瘤和引流淋巴结中的OVA特异性CD8+ T细胞显著增加,而在CXCR3+ Tregs的背景下则没有。这种效应依赖于DC1的存在。使用结合SIINFEKL/H-2Kb复合物的抗体进一步确认了DC1对肿瘤抗原的交叉呈递增强。
总的来说,这些结果描述了一种机制,即CD8+ T细胞产生的IFNγ增强了DC1中CXCL9的表达,从而招募CXCR3+ Tregs。这些CXCR3+ Tregs反过来增加了CXCL9+ DC1的数量,但限制了DC1对肿瘤抗原的交叉呈递,阻碍了抗肿瘤CD8+ T细胞的激活过程,并限制了它们对癌症进展的控制能力。Tregs中的CXCR3敲除增强了DC1的交叉呈递、CD8+ T细胞的激活和抗肿瘤效果,这表明CXCR3可能成为癌症免疫治疗的潜在靶点。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏