17.6 炎症中的色氨酸双加氧酶(TDO): 免疫逃逸、失巢凋亡抵抗和转移
在肝脏中表达的TDO负责维持血液中色氨酸水平的动态平衡。与IDO1类似,一些肿瘤以过度表达TDO的方式进行免疫逃避。
因此,人们对TDO的小分子抑制剂越来越感兴趣,将其作为一种并行的免疫调节策略来消除肿瘤,最近该领域的先行者已详细地回顾了其基本原理。
最初在20世纪90年代开发的生物活性铅结构68OC91已被用于小鼠研究,并且有报道称,优化产生的效力更强,药理特征更好的化合物也已经研发出来。
小鼠体内TDO编码基因TDO2的缺失导致血液中L-色氨酸浓度升高,一些神经系统改变可能与这些小鼠血/脑中5-羟色胺水平的协同升高有关。有趣的是,用TDO2抑制剂680C91治疗的小鼠,对内毒素诱导的休克的敏感度明显升高,TDO2−/−小鼠也具有类似的现象,这意味着TDO参与了炎症过程。
然而,尽管与IDO1或IDO2类似,但TDO似乎赋予的炎症特征存在差异,尽管这些酶在色氨酸分解代谢中发挥着共同作用。虽然酶学差异可能有助于解释这些不同的作用,但它们似乎也反映了犬尿氨酸及其代谢物产生的局部区域控制或犬尿氨酸效应机制(AhR、犬尿氨酸途径分解代谢酶等)的相对可用性或效率的差异。
关于TDO,虽然有通过选择性生物活性抑制剂在临床前阶段的证据表明它在肿瘤免疫逃逸中的作用,但目前在小鼠身上还没有遗传证据,也没有关于TDO在肿瘤细胞或肿瘤微环境中表达的性质或程度的了解。
此外,如在文章其他部分讨论的那样,TDO抑制剂引起了与IDO1抑制剂不同的安全性问题,包括在肝脏和中枢神经系统中。尽管如此,TDO抑制剂以及IDO/TDO组合抑制剂的开发仍在继续。
近期有证据表明,TDO参与了IDO1等与癌症相关的炎性过程。具体地说,癌细胞中TDO的上调已被发现对肿瘤细胞的存活和转移能力有促进作用,而不仅仅是它在免疫逃逸中的作用。
对失巢凋亡的抵抗是肿瘤转移过程中的关键步骤,它是一种由细胞黏附剥夺触发的细胞凋亡。在一项对侵袭性“三阴性”乳腺癌(TNBC)的开创性研究中,D’Amato和他的同事展示了强制悬浮培养中TDO的上调是如何在TNBC细胞的失巢抵抗和转移能力中发挥重要作用的。
与其在免疫逃逸中的作用相似,由TDO上调引起的犬尿氨酸诱导足以激活AhR信号通路,而对TDO或AhR的药理抑制或遗传衰减均足以恢复失巢细胞的敏感性并降低TNBC细胞的侵袭性。支持这些观察结果的证据是,用TDO抑制剂680C91治疗的荷瘤小鼠肺转移减少。
最后,TDO在临床TNBC标本中的高表达与疾病分级增加、雌激素受体阴性状态和总生存期缩短有关。这些发现提供了这样一个概念,即TDO的作用类似于IDO1,在癌症中驱动致病性炎症过程,其范围超出了它们对实现适应性免疫耐受的贡献。
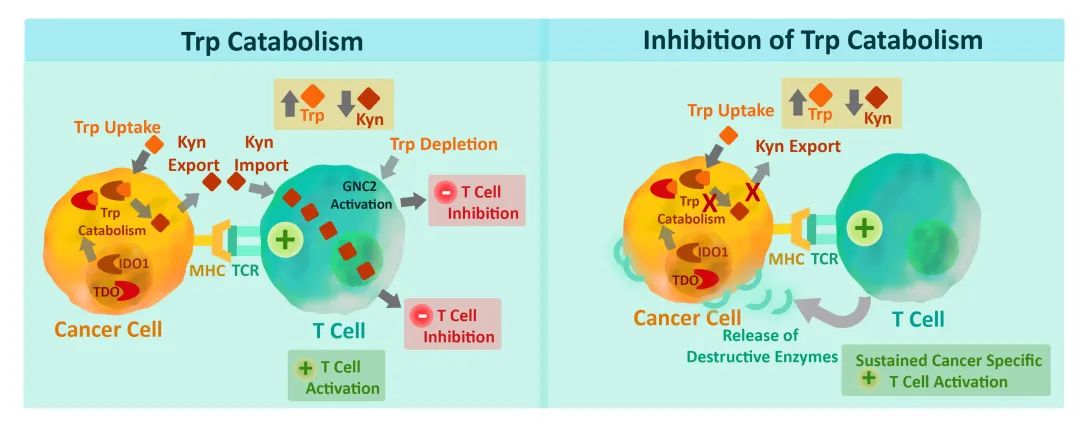
Fig. 17.3总结了IDO/TDO抑制剂通过影响炎症过程和适应性抗肿瘤免疫反应来影响免疫检查点治疗和化疗的一些情况。
Fig. 17.3 IDO/TDO抑制剂利用免疫检查点治疗和化疗。IDO/TDO抑制剂不仅在联合治疗方案中有效,作为免疫调节剂缓解免疫逃逸和促进适应性免疫反应,而且还可以消除或重新编程炎症过程,影响化疗和免疫检查点治疗。
17.7主要临床用药:吲哚莫德、GDC-0919和艾卡哚司他
17.7.1 吲哚莫德
我们曾在别处发表过详细的关于临床前研究的讨论,并基于理论基础对这种简单的D-色氨酸的1-甲基衍生物进行临床评估。到目前为止,临床前文献中研究IDO最常用的分子探针是1-甲基-色氨酸的D,L外消旋混合物(1MT)。L-1MT是IDO的弱底物而不是真正的抑制剂;D-1MT既不是IDO的底物,也不是IDO的抑制剂,尽管在多种模型系统中,它表现出相对更强的抗肿瘤特性,这与IDO介导的人树突细胞色氨酸分解代谢的抑制相关。所以它也不是选择性探针。
吲哚莫德是第一个进入I期试验的化合物,在多次II期试验中发现当它作为单一药物或与化疗联合使用时具有良好的耐受性,且该研究对每天1200毫克的剂量进行了评估。
在这项工作中,有三个值得关注的试验集,联合应用Taxotere(化疗联合)的乳腺癌患者,联合应用树突状细胞疫苗siPuleucel-T(疫苗联合)的前列腺癌患者,以及联合抗PD1(免疫检查点联合)的黑色素瘤患者。
虽然尚未确定吲哚莫德确切的作用机制,但细胞实验可反映,mTORC1通路将临床相关的纳摩尔浓度的吲哚莫德转变为l-色氨酸的模拟物。因此,吲哚莫德可能部分减轻IDO-/TDO-介导的色氨酸剥夺对T细胞抗肿瘤活性(需要mTOR信号)的抑制。深入研究后发现了吲哚莫德这种简单的D-色氨酸衍生物的确切的作用机制,它的低毒性仍然是其临床开发中吸引人的特征,也促进了IDO1和IDO/TDO酶抑制剂的研究。
17.7.2 GDC-0919
在2005年之前,几乎没有动力开发IDO1这种不起眼的色氨酸分解代谢酶的抑制剂。这种情况在得到IDO1在癌症中的作用以及IDO1抑制剂与化疗联合作用效果的临床前证据时发生了改变。
在2005年,唯一具有生物活性的IDO抑制剂是1-甲基-D, L-色氨酸(1-MT),其Ki据报道是34 μM。1989年Sono和Cady将4-苯基咪唑(4-PI)确定为IDO1的弱非竞争性抑制剂,它是当时为数不多的被报道的IDO抑制剂之一。有趣的是,尽管在光谱研究中4-PI显示非竞争性抑制,但Sono和Cady认为4-PI实际上是与活性部位的血红素铁结合的。随后,第一个被报道的IDO的晶体结构通过显示4-PI与血红素铁结合证实了这一发现(Fig. 17.4a)。这一发现以及丰富的晶体结构信息促使Malachowski和他的同事们开始了第一次基于结构的药物设计研究,他们进行的关于苯并咪唑系列的开创性工作,促使了后来的临床先导药物GDC-0919的诞生。
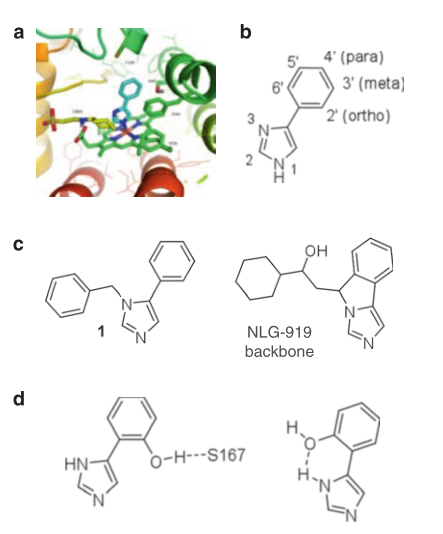
Fig. 17.4 苯基咪唑类药物植根于GDC-0919开发。(a)4-PI与IDO1的血红素铁结合。C129位于4-PI苯环的上方,而S167位于结合部位的后面。缓冲分子CHES(黄色)在IDO晶体结构的活性中心的入口处结合。由Delano Science LLC开发、支持和维护的开源分子图形系统PYMOL1.0[http://wwwpymol.org]生成图形。http://www.delanoscientific.com.(b) 4-苯基咪唑结构的环编号。(c)N-3-苄基取代4-PI的结构和NLG-919的根结构。(d)两个可能的4-PI核2‘-OH取代的益处。
Malachowski和他的同事在早期的基础性工作中探索了4-PI的类似物,通过修改结构以探索IDO1的活性部位,主要利用了IDO活性部位内的三种结合作用:(1)作用于血红素7-丙酸修饰的活性部位入口区,(2)作用于活性部位的内部,特别是与C129和S167的相互作用,(3)作用于血红素铁结合基团。
通过活性中心入口处的相互作用增强了4-PI结构的IDO抑制作用,该作用集中在咪唑环的N-1、C-2和N-3位(Fig. 17.4b)。这三个位置都被取代以增加占据活性中心入口的基团。在4-PI与IDO的晶体结构中,该区域含有N-环己基-2-氨基乙磺酸(CHS)缓冲分子,其烷基部分与F163和F226形成疏水相互作用。此外,CHES分子的氨基与血红素7-丙酸形成离子对。
N-1取代的4-PI衍生物完全没有抑制活性并不令人惊讶,它证实了N-1氮与血红素铁的结合,更重要的是,证明了咪唑的N-3氮不能取代结合在血红素铁上。然而,意外地发现N-3苄基取代的衍生物(Fig. 17.4c1)与4-PI大致等价,从而证明咪唑环是可以取代的。N-3-苄基取代化合物确定了正确的咪唑环位置及空间容差,可能占据了活性中心入口,其中CHS缓冲分子位于IDO-4-PI晶体结构中。这一发现与油菜素衍生物抑制IDO1的研究中开发的药效团是一致的,即在两个大的芳香族或碳氢化合物结构的两侧是一个血红素铁结合基团。NewLink Genetics Inc.随后在临床候选药物NLG-919(Fig. 17.4c)的骨干结构方面的开发工作也证明这是具有先见之明的,在授权给Genentech/Roche后将其重命名为GDC-0919。如图所示,NLG-919主干从相同的N-3位置延伸到IDO1的活性中心入口处,位于相似的碳氢化合物部分。
通过分析4-PI与IDO1结合的晶体结构,可以证明S167和C129位于活性中心内部的4-PI的苯环附近。对苯环与氧、硫和氟的邻位、间位和对位取代进行了系统的评估,以确定是否可以利用特定的蛋白质-配体相互作用。2‘-羟基(邻位取代)修饰效果最好,效价比4-PI提高了10倍(Fig. 17.4d)。这种效价的提高有两种可能性:与s167分子间氢键或与N-3分子内氢键锁定的苯环和咪唑环还合成了2‘,6’-二羟基苯基衍生物,它提供了s167或N-3-咪唑的两个旋转体中的羟基,并且它与2‘-羟基衍生物大致相等,表明了这两个羟基没有额外的作用。随后,NewLink Genetics引入了一种将氢键复制到N-3咪唑上的碳氢桥,即将苯和咪唑环的构象锁定在一个平面上。
Malachowski和他的同事还对血红素铁结合咪唑环的修饰的关键及其对IDO1抑制的影响进行了探索。为了探讨杂环与血红素铁的结合作用,用取代芳环取代了4-PI的咪唑。这些变化导致了化合物与4-PI相比效力较弱。例如,吡啶、噻唑、吡唑和呋喃都没有表现出任何抑制作用。众所周知咪唑是一种铁配体,例如组氨酸,据推测,噻唑、吡唑和呋喃都不能以与其相同的亲和力结合到血红素铁上。4-PI的苯基可替换为噻吩基,尽管活性损失了大约五倍。只有当苯环上的羟基返回时,活性才能恢复或比4-PI略有提高。如前所述,这与羟基与吡唑氮形成分子内氢键并将两个环锁定在同一平面上是一致的。虽然这些研究表明咪唑基团在与铁结合强度和形状互补性方面都是最优的,但随后的研究表明三唑类化合物也具有相关的活性。总体而言,早期研究发现了关于苯并咪唑系列的三项关键发现,促进了NLG-919/GDC0919的开发:(1)N-3取代是允许的,活性中心存在较大的空间来容纳该位置的碳氢化合物部分;(2)引入邻位羟基是有利的;(3)咪唑环与血红素铁的结合效果最好。
临床前研究表明,GDC-0919在细胞检测中作为IDO1抑制剂,EC50=75 nM,对TDO的选择性为10-20倍。GDC-0919是一种口服生物利用度药物,具有良好的药代动力学和毒性。口服给药可使小鼠血浆中犬尿氨酸水平降低约50%。在人IDO1+的树突状细胞的同种异体混合淋巴细胞反应中,GDC-0919阻断了IDO1诱导的T细胞抑制并在体外恢复了T细胞反应。在B16黑色素瘤小鼠模型中,联合应用了GDC-0919与PMEL-1 T细胞和gp100多肽疫苗,在接种后的4天内,肿瘤体积相对减少了95%。此外,在EMT6同基因模型中,将GDC-0919与抗PD-L1抗体相结合可提高相对抗肿瘤效果。联合应用导致CD8+T/Treg比值升高以及血浆干扰素-γ水平升高。GDC-0919还能激活瘤内巨噬细胞和树突状细胞。
到目前为止,在临床上GDC-0919的单一疗法已用于复发/晚期实体瘤患者身上,并报告了1a期试验的安全性、药代动力学和药效学结果。总体而言,GDC-0919在21/28天的周期中血浆含量高达800毫克。17例患者中有7例病情稳定。GDC-0919的血浆含量从50 mg增加到800 mg,血浆犬尿氨酸水平在给药后4h短暂下降~30%,与预测的药物半衰期一致。据报道,GDC-0919的安全性、药动学和药效学正在通过连续给药计划(BID,28/28天)进行评估。GDC-0919与抗PD-L1抗体阿特唑珠单抗(NCT0271846)的联合使用仍在研究中。
17.7.3 艾卡哚司他 (INCB024360)
艾卡哚司他的开发代号为INCB24360,是走在临床开发方面前沿的Incyte公司首创的羟胺系列IDO1选择性抑制剂的主要临床药物。领导该项目的Incyte团队在最近发表的关于其鉴定和结构的文章中介绍了艾卡哚司他开发中探索的细节。艾卡哚司他在临床前研究基于细胞的分析中选择性地抑制人IDO1的色氨酸分解代谢活性(IC50=10 nM),对IDO2和TDO2几乎没有活性。在人同种异体淋巴细胞与树突状细胞或肿瘤细胞共培养时,艾卡哚司他可促进效应T细胞和NK细胞的生长,减少原始T细胞向Tregs的转化,并增加CD86 高表达树突状细胞的数量。与这些效应一致的是,同基因荷瘤小鼠在给药后,血浆和肿瘤中的犬尿氨酸水平均被抑制了~90%,免疫功能正常且不低下的小鼠的肿瘤生长受阻,这证实了药物疗效依赖于功能免疫。此外,在B16黑色素瘤模型中,研究发现艾卡哚司他可以增强抗CTLA4或抗PDL1抗体的抗肿瘤效果,其中IL-2的产生和CD8+T细胞的增殖表明,联合比单独使用这两种药物具有更明显的效果。
艾卡哚司他的临床评价以人类首个I期研究开始,研究其安全性、最大耐受量、药代动力学、药效学和抗肿瘤活性。在这项研究中,艾卡哚司他总体耐受性良好,可以有效地使血浆犬尿氨酸水平正常化,并在>100 mg Bid的剂量下对IDO1活性有最大抑制作用。虽然没有检测到客观反应,但在52例患者中有7例观察到疾病稳定时间持续≥16周的。在晚期黑色素瘤患者中进行了一项联合应用艾卡哚司他和易普利姆玛的研究。用25毫克和50毫克剂量的艾卡哚司他都普遍耐受性良好。值得注意的是,根据免疫相关反应标准(IRRC),31%的ORR包括3/32例完全应答的患者。在没有控制的情况下,IRRC对没有接受过免疫治疗的患者的中位PFS为8.2个月。与之前报道的易普利姆玛相比,疗效终点更有利,后者显示11%的ORR,中位PFS为2.86个月。
艾卡哚司他目前正在14种肿瘤类型中进行研究,与抗PD-1抗体(纳武利尤单抗或帕博利珠单抗)或抗PD-L1抗体(阿替利珠单抗和度伐利尤单抗)联合使用。早期的帕博利珠单抗联合用药数据表明,该联合用药耐受性良好,具有良好的临床活性。在19例治疗初期的晚期黑色素瘤患者中,4例完全缓解,7例部分缓解,3例疾病稳定,客观缓解率为58%,疾病控制率为74%,在所有剂量队列中有效率≥50mgBid,靶病变部位包括肝、肺和淋巴结。在介绍时报告的所有答复都已得到确认并在进行中,尚未达到中期方案的执行情况。在黑色素瘤患者中,这些结果优于帕博利珠单抗治疗或纳武利尤单抗- 易普利姆玛联合治疗。在艾卡哚司他-帕博利珠单抗联合研究中,观察到了以下患者的反应:曾经治疗过的晚期黑色素瘤患者(n=3;1CR,1SD);非小细胞肺癌(n=12;5PR,2SD)、肾癌(n=11;3PR,5SD)、子宫内膜腺癌(n=7;1CR,1PR)、TCC(n=5;3PR)、TNBC(n=3;2SD)和SCCHN(n=2;1PR,1SD)。基于这些结果,2016年6月启动了一项第三阶段随机、双盲、安慰剂对照研究,调查帕博利珠单抗与艾卡哚司他或安慰剂联合治疗晚期或转移性黑色素瘤患者的一线治疗效果(ECHO-301[NCT02752074])。预计将于2017年开始对肺癌、肾癌、头颈部癌和膀胱癌的其他研究。
17.8 其他IDO/TDO抑制剂临床候选药物
据报道,更多的IDO1抑制化合物正在进入临床测试。PF-06840003是一种色氨酸非竞争性、非血红素结合的IDO1抑制剂,由iTeos SA授权辉瑞用于临床开发(Wyths等人,SITC2016,Post253)。这种化合物被预测具有良好的人类PK特性,它半衰期相对较长,可能允许每天单次给药,并且中枢神经系统的穿透特性可使其有效地到达脑转移瘤。在临床前研究中,PF-06840003增强了抗PD1/PDL1轴阻断的抗肿瘤效果。2016年启动了一项首次针对恶性胶质瘤的住院研究(NCT02764151)。
BMS-986205是Flexus Inc.授权Bristol-Myers Squibb进行临床开发的一种IDO1抑制剂。据报道,与艾卡哚司他和GDC-0919相比,该化合物具有更好的效力和药代动力学,并于2015年进入实体肿瘤1期研究,进行了单一疗法研究和与纳武利尤单抗(NCT02658890)联合使用研究。到目前为止,其他几种IDO1抑制剂仍处于临床前开发的晚期阶段,报道的信息很少。Fig. 17.5列出了上述所有化合物的信息摘要。
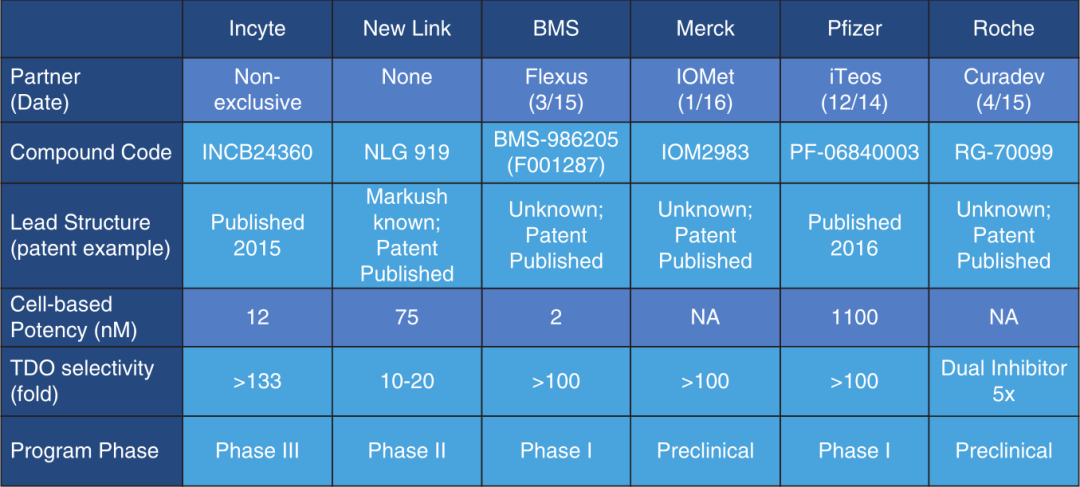
Fig 17.5 临床试验中的IDO1抑制剂信息
本文由Oncolab微信公众号翻译整理自Oncoimmunology: A Practical Guide for Cancer Immunotherapy,仅用于学习交流使用,如需购买原版书籍可点击阅读原文购买。
— THE END —
▉ 强烈推荐
▉ OncoLab实验室网站
本公众号上的往期文章同步发布至对应网站OncoLab实验室。
网站自带检索功能,可以根据关键词进行检索,并且可以根据日期及内容分类进行查看 ,大家可以收藏方便在电脑上查看。
网址是:oncolab.cn
▉ OncoLab学术导航
此外,梳理了一下这几年攒的收藏夹,做了一个导航网页,包含常用网站、文献阅读、试剂订购、基金相关、实用工具、常用数据库等分类内容,并且整合了百度、谷歌、必应三大搜索引擎到检索工具中,欢迎收藏或设置为主页使用~
网址是:dh.oncolab.cn
▉ OncoLab知识星球
OncoLab知识星球也已开通,在学习本公众号内容的过程中如果有什么需要讨论交流的地方可以在星球发表留言,也可以分享一下自己的学习心得体会,其他小伙伴看到了可以积极留言回复,我也会积极参与其中,并时常放一些学习资料在上面,希望大家能够在积极交流互帮互助中共同进步~
该星球用于OncoLab公众号读者交流学习使用,永久免费。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏