5.1 引言
基因突变可以诱导细胞转化,从而导致肿瘤的发生,而免疫系统通常可以检测并防止肿瘤的形成(Burnet在1957年提出最初假设)。本书其他部分讨论的免疫监测过程的参与者包括先天效应器和先天分子,如γδT细胞、自然杀伤细胞(NK)、树突状细胞(DC)、自然杀伤T细胞(NKT)、TRAIL、穿孔素/颗粒酶以及适应性免疫反应的成员(B细胞和T细胞)。RAG2是B细胞和T细胞生成所必需的,因此与野生型小鼠相比,缺乏重组激活基因2(RAG2)的小鼠更容易发生自发或化学诱导的肿瘤。T细胞是清除病毒、原生动物和细胞内细菌感染所必需的,是癌症免疫监测的关键因素。在临床前癌症模型中,CD8抗体被证明能有效阻止可移植肿瘤的自发排斥。随后,适应性免疫反应被证明是防止诱变剂诱导肿瘤生长的关键因素。有趣的是,在癌症生长的平衡阶段(癌细胞持续存在,但受到免疫系统的控制),CD4和CD8 T细胞的耗竭恢复了癌症的进展,再次强调了T细胞在长期控制癌症生长中的重要性。
T细胞是抗癌治疗中必不可少的效应细胞。各种抗癌药物的抗癌效果不仅取决于它们杀死癌细胞的能力,还取决于它们诱导T细胞依赖性抗癌反应的能力。因此,抗肿瘤治疗的特征之一是诱导针对肿瘤抗原的免疫应答能力。事实上,放疗和化疗不仅可有效介导肿瘤细胞直接死亡,还能够促使死亡细胞释放细胞因子,如“损伤相关分子模式”,这种分子模式此前已被证明会引发T细胞依赖性免疫反应,并有助于肿瘤的消除。T细胞反应的诱导依赖于先天性免疫细胞和适应性免疫细胞之间的密切合作。首先,树突状细胞(DC)捕获肿瘤抗原并在晚期内体中对抗原进行必要的处理。随后,DC激活后从肿瘤区域迁移到引流淋巴结并完全成熟。抗原肽在DC中MHC I类和II类分子的协助下呈递给抗原特异性CD4和CD8 T细胞,并触发其激活(信号1)。共刺激分子的识别(信号2)和成熟DC产生的细胞因子(信号3)导致T细胞的极化和完全激活。最后,DC驱动T细胞上趋化因子受体的表达,从而使它们迁移至肿瘤区域以消除肿瘤细胞。
T细胞亚群分类的方法之一是根据其CD62L和CCR7的表达。次级淋巴器官的T细胞高表达这两种标记物,在遇到DC后可能被激活。尚未被抗原激活的原始T细胞(TN)以及其他两个已经与抗原结合的T细胞亚群,即中枢记忆细胞(TCM)和T记忆干细胞(TSCM),都属于这一类。这些细胞主要位于淋巴器官,具有较强的增殖能力。相比之下,其他T细胞亚群,包括效应记忆T细胞(TEM)和效应T细胞(TEFF)位于执行其效应功能的周围组织中。这些细胞的CD62L和CCR7表达是显著下调的,在激活后具有强大和快速的促炎细胞因子分泌功能,并表现出针对抗原靶点的细胞毒性活性。不同的细胞亚群在肿瘤环境中的作用已经有过描述。
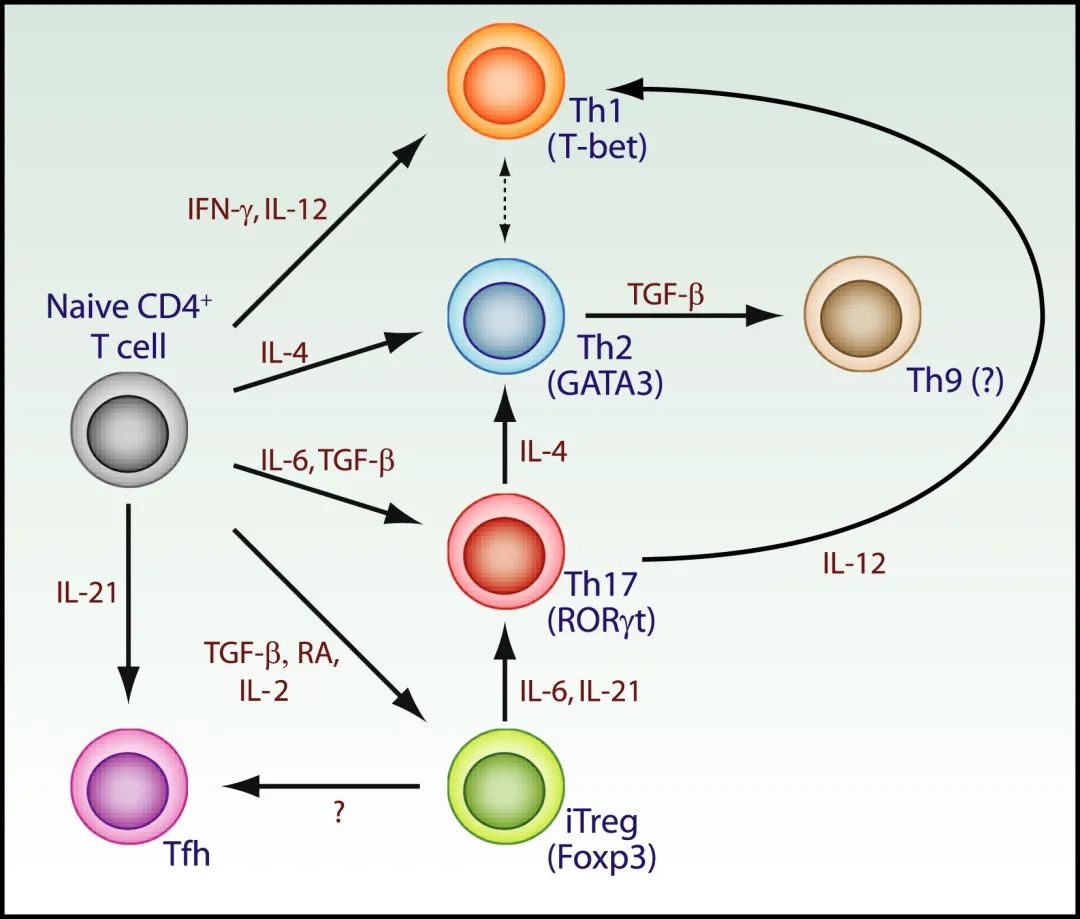
幼稚的CD4 T细胞分化成几个亚群,这些亚群表达不同的转录因子,分泌不同的细胞因子,并发挥各种免疫功能。这导致了不同CD4 T细胞之间功能异质性的概念。Th1细胞分泌IFN-γ并限制由细胞内细菌引起的感染,而Th2细胞分泌IL-4、IL-5、IL-10和IL-13,使免疫反应偏向体液免疫。自Th1/Th2二分法出现后,又发现了一些效应和调节性CD4 T细胞的新亚群,例如分泌IL-17并促进炎症的Th17细胞,表达Foxp3转录因子并抑制免疫反应的Foxp3调节性T细胞(Treg),分泌IL-10的Tr1细胞也可调节免疫反应,并依赖转录因子c-Maf和AhR进行发育。Th9细胞在TGF-β和IL-4存在的情况下可从初始CD4 T细胞分化而来,随后被鉴定为表达PU.1转录因子并分泌细胞因子IL-9的CD4 T细胞。虽然Th9细胞最初被证明在结肠炎、哮喘和实验性自身免疫性脑脊髓炎(EAE)中发挥促炎作用,但在最近已经证明在多发性硬化的小鼠模型中,这些细胞在体内过继转移后表现出强大的抗癌特性。总的来说,T细胞分化为不同类型效应细胞的能力将决定适应性免疫反应的质量和程度,并与大量疾病明确相关。在这里,我们将回顾T细胞分化,重点是决定T细胞命运的分子机制。这部分不讨论直接利用T细胞特性治疗癌症的一些应用而是重点关注T细胞分化的分子机制,第2、3、4和5部分将充分讨论T细胞调控与肿瘤治疗的相关性。不过在本章中,我们将会介绍一些由于T细胞分化缺陷所导致的人类疾病。
5.2 T细胞分化的转录和表观遗传调控
5.2.1 转录因子是调节CD4+ T细胞分化的先驱和主要途径
当从CD4+ T细胞分化出辅助性T细胞(TH)和调节性T细胞(Treg)时,代表了相对较晚期的分化阶段。抗原和细胞因子是T细胞通过T细胞受体(TCR)和细胞因子受体感受到的关键细胞外信号。将抗原连接到TCR可激活转录因子(TF),如核因子-κB(NF-κB)、活化T细胞的核因子(NFAT)和激活蛋白1(AP-1),而与同源细胞因子受体结合的细胞因子可激活信号转导子和转录激活因子(STAT)。TCR与MHC分子上其同源抗原的亲和力,还有共刺激受体-配体的相互作用,联合起来将产生不同强度的胞浆信号,从而控制下游TFs的活动。TCR信号的强度变化通过调节CD4+ T细胞亚群对不同细胞因子的反应、诱导特异性细胞因子受体的表达,或影响特异性STAT的激活来影响CD4+T细胞亚群的分化。通常强TCR信号有利于TH1、TH17和TFH细胞分化,而弱TCR信号促进TH2细胞和诱导的Treg细胞(iTreg)的发育(Fig 5.1a)。细胞因子通过I/II型细胞因子受体超家族发出信号,该家族使用Janus激酶(JAK)–STAT信号通路将环境信号转换为启动特定基因表达程序的内在信号。STATs是DNA结合调节蛋白,能够驱动选择性基因表达程序,促进特定TH细胞亚群的分化。通过TCR和细胞因子受体信号对细胞外环境的感知可激活一个协同作用的先导TFs网络,从而调节整体染色质状态和TH特异性主调节因子的表达。值得注意的是,AP-1、干扰素调节因子(IRF)、STATs和NFAT等因子招募了共同激活剂,如染色质重塑剂、组蛋白乙酰转移酶(如p300)和负责组蛋白甲基化的酶(如H3K4me1)。这些染色质修饰因子可增加调节元件的可塑性。最后,先导TFs因子网络的激活构建了CD4+T细胞主调节因子结合并介导谱系特异性基因表达程序所必需的特定表观遗传模式(Fig 5.1a)。
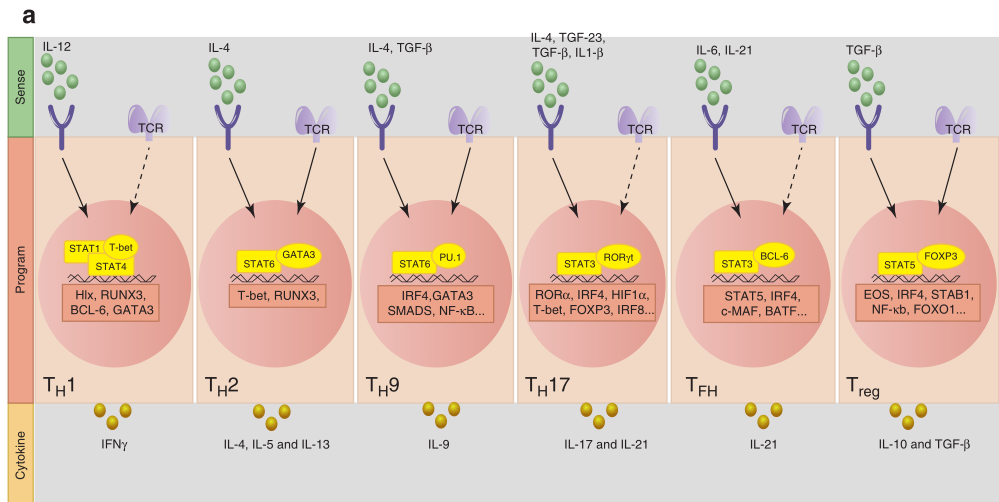
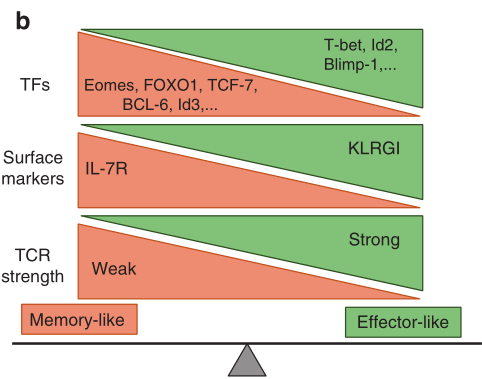
Fig 5.1 T细胞分化。(a)CD4+T细胞分化:TH1:结合强TCR激活,IL-12通过STAT4的磷酸化和核易位启动TH1细胞分化,然后结合靶基因的调节元件,如IRF1和IFN-γ。(b)TFs在效应与记忆性CD8+T淋巴细胞命运决定中的作用:可以促进效应器样或记忆样分化的关键因素的一个突出例子。
最初,CD4+T细胞主调节因子被描述为与不同功能谱系相关的TF,这些TF对于驱动特定细胞命运至关重要且是充分的。T-bet是TH1细胞的主要调节因子,GATA3是TH2细胞的调节因子,PU.1是TH9细胞的调节因子,RORγT是TH17细胞的调节因子,BCL-6是TFH细胞的调节因子,FOXP3是Treg细胞的调节因子(Fig 5.1a)。多个研究小组的数据表明,TH1细胞或TH2细胞的表观遗传特征分别因T-bet或GATA3的缺失而受到干扰,尽管在缺乏T-bet和GATA3的细胞中,编码谱系定义细胞因子的mRNA转录减少。这些数据证实虽然T-bet和GATA3等TFs控制与TH1和TH2细胞相关的一些关键基因的表达,但这些谱系的基本特性是由其他转录事件确定的,受上游先导因子的指导,调节整个转录网络对基因调控关键位点的可及性。然而,尽管主调节因子的调节范围相对较小,但体内功能丧失性研究的结果显示出主调节因子在细胞表型、环境反应性和可塑性的遗传维持中的重要性。例如在体内,FOXP3对Treg细胞的特性至关重要,成熟Treg细胞中FOXP3的缺失导致其去分化、获得替代性T细胞亚群表型和广泛的免疫病理学特征。此外,主调控因子参与核心谱系TFs表达的正反馈环,并增强协同调控基因的表达,从而适应和稳定转录程序。主调控因子同时抑制其他谱系相关的基因的表达,如其他相反谱系的主调控因子或细胞因子。
5.2.2 控制效应型和记忆型T细胞分化平衡的多因子表达梯度
活化的CD8+ T细胞暴露于无数信号,如细胞因子、生长因子和环境信号。这些信号是如何被传输到细胞中,并转化为基因表达模式,从而促进效应分化,同时也保存了能够自我更新的长寿命和多能的细胞呢?这是一个重要的问题。尽管CD8+ T淋巴细胞的功能多样性低于CD4+ T细胞,但在TFs作用下依然可以分化为Tc1、Tc2、Tc9、Tc17或调节性CD8+ T等多种类型。得到证实的是,越来越多的TF与效应或记忆T细胞在生物学的各个方面有关。对于Tc1的分化,BCL-6、Blimp-1、Eomes、Id2、Id3、TCF-7、Foxo1和T-bet的表达对是分化为效应型还是记忆型具有决定性作用。此外,IRF4已被证明对效应体和记忆Tc1的分化至关重要。与CD4+ T细胞中IRF4的功能类似,IRF4在CD8+ T细胞向Tc9和Tc17细胞分化过程中起着至关重要的作用,而只有少数CD8+ Treg细胞表达家族特异性因子Foxp3 (Table 5.1)。

Table5.1 效应CD8+T细胞亚群、其极化细胞因子和对其分化重要的转录因子.
在CD8+ T细胞分化的转录调控中,一个重要的概念模型是,一对对转录因子以相反的方式作用,调控效应与记忆性CD8+ T细胞(Fig 5.1b)。例如,在活化的CD8+ T细胞中,T-bet的表达最初由TCR信号诱导,然后由IL-12信号增强。在病毒特异性CD8+ T细胞中,与KLRG1loIL-7Rhi记忆前体效应CD8+ T细胞相比,KLRG1hiIL- 7rlo短寿命效应CD8+ T细胞中T-bet表达升高。这一发现提示T-bet的表达像变阻器一样控制效应型CD8+ T细胞分化和记忆型CD8+ T细胞电位之间的平衡。较高数量的T-bet指示KLRG1hiIL-7Rlo效应细胞的形成,但较低数量的T-bet似乎意味着正常的记忆细胞形成。eomesdermin (Eomes)是另一种在活化的CD8+ T细胞中表达的T-box因子,它对CD8+ T细胞中CD122和穿孔素的表达也很重要。一方面,T-bet和Eome似乎在CTL功能和记忆T细胞稳态中合作。T-bet和Eomes协调CD122在记忆性CD8+ T细胞中的表达,CD8+ T细胞在淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染期间,这两种基因均双缺陷,不能产生CTL。相反,Tbx21−/−Eomes−/−CD8+ T细胞会异常分化为产生IL-17的CD8+ T细胞,导致中性粒细胞过度浸润和致人死亡的炎症综合征。另一方面,与T-bet相反,IL-12抑制Eome的表达并随着记忆性CD8+ T细胞的形成和成熟,Eome的表达增加。这种平衡也适用于转录因子对Id2和Id3,以及Blimp-1和BCL-6和其他转录因子对(Fig 5.1b)。虽然上述模式主要表现在CD8+ T细胞中,但同样的系统似乎也控制着CD4+ T细胞的记忆。据报道,Blimp-1和BCL-6对CD4+ T细胞的记忆亚群有影响。
一个TF或一对TF可以控制整个分化程序的经典概念显然是过于简单化了。较为关键的TF(如上面描述的那些)实际上是由许多局部绑定的辅因子操控的。已知TFs之间的组合、相互作用和与组织特异性表达的相关性导致的组织特异性表达模式将由大约15个TFs组成的网络来完成。因此,一个特定的TF可能在多个组织中表达,但只有一组特定的TF在一个给定组织中的共表达和共定位,才能使它们相互作用。BATF或IRF4的缺失都极大地扰乱了CD8+ T细胞免疫应答的早期阶段,导致初始增殖后效应期功能减弱。有趣的是,这还伴随着大量与CD8+ T细胞激活相关的基因调控中断,包括编码关键TFs的基因和控制代谢的分子,以及与效应功能相关的分子。所以,探究BATF和IRF4在CD8+T细胞应答中调控染色质可及性的作用对于阐明初始T细胞的激活如何建立适合谱系特异性基因表达的染色质景观至关重要。有强有力的证据表明,具有强大记忆潜能的细胞在免疫反应的早期就建立起来了,它是怎样受到可能的早期的基因可及性修饰的影响是一个关键问题。理解异质性如何在效应人群中产生并有助于记忆形成的另一个重要组成部分可能包括对不同CD8+ T细胞亚群的增强子和调节区域的描述,以及它们在免疫反应的不同阶段的可及性,还包括对于结合这些区域的因子的鉴定。该领域的一个主要挑战将是将这些信息与如上所述的转录因子、microRNA和长非编码RNA的数据相结合,以产生对决定淋巴细胞异质性命运的事件的全面理解。
5.2.3 ncRNA在T细胞分化的表观遗传控制中的作用
非编码RNA(Non-coding RNAs, ncRNAs)主要分为两大类。例如,miRNAs属于小的ncRNAs,通过与靶mRNA转录本的编码区或非翻译区(UTR)结合,导致mRNA降解或翻译抑制,从而调控基因表达。长ncRNA具有高度的组织和物种特异性,有报道称其在基因调控中具有重要作用。
microRNA加工内切酶Drosha和Dicer基因的缺失导致TH细胞稳定性和功能出现紊乱,提示ncRNA在T细胞分化中发挥作用。不同的研究建立了一个“microRNome”或“lncRNome”来分类一组在小鼠和人类淋巴细胞Th细胞分化过程中调节谱系类型的microRNA和lncRNA。其他几项研究着重于识别调控TH细胞发育和功能的独特miRNA(Table 5.2)。
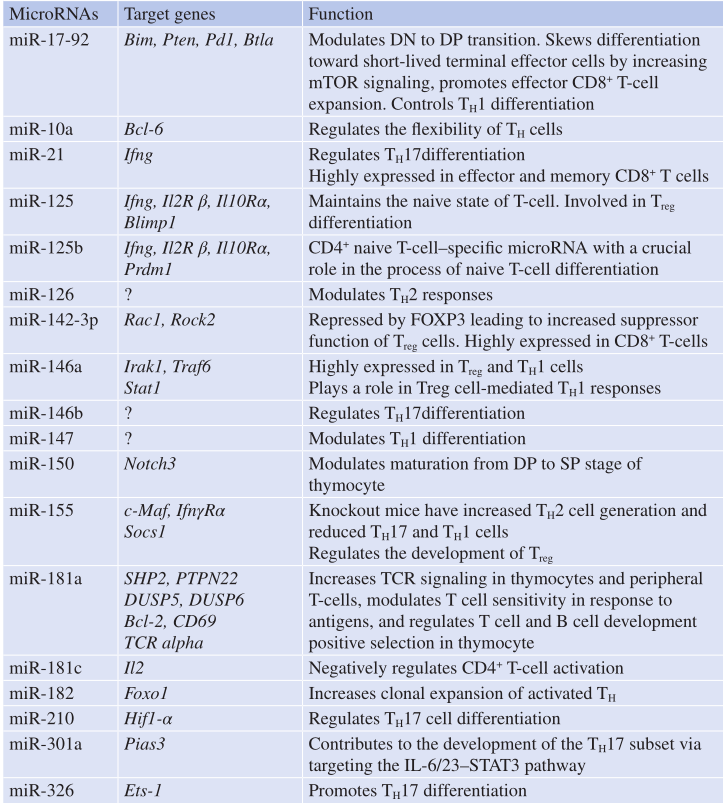
Table 5.2 与T淋巴细胞分化相关的microRNA
lncRNA使用一系列不同的分子机制来调节基因表达。一些lncRNA与T细胞的分化和功能有关。例如,NRON lncRNA调节NFAT功能,GAS5 lncRNA阻止T细胞生长,NeST lncRNA在TH1细胞中选择性表达,驱动IFN-γ表达。有团队对小鼠CD8+ T细胞中的lncRNA进行整体分析,发现了几种可能调节其激活和分化的lncRNA。
5.3 代谢状态与T淋巴细胞分化
T细胞谱系的分化与细胞代谢程序的变化密切相关。糖酵解、脂肪酸和线粒体代谢等关键代谢过程是影响T细胞激活和分化的关键因素,它们的调节可以不同程度地影响T细胞的命运和功能。
5.3.1 T细胞激活过程中的代谢重编程
在代谢活动方面,初始T细胞处于静止状态。在抗原识别后,CD4+和CD8+ 初始T细胞变得高度增殖和分化。在TCR刺激下,糖酵解相关基因的表达上调,包括细胞外营养物质转运体的表达,导致代谢重编程,在此过程中细胞大量增加营养物质的摄取,尤其是葡萄糖。这种代谢重编程是在雷帕霉素靶点mTOR的控制下进行的。mTOR是一种蛋白激酶,作为各种环境信号的中心整合者,能够相应地调节多种细胞过程 (Fig 5.2a)。其中包括自噬、葡萄糖摄取和消耗(糖酵解)、蛋白质和脂质合成的控制,这些都是T细胞激活的关键过程。活化的T细胞参与有氧糖酵解过程。有趣的是,在T细胞中,糖酵解对GAPDH的调节非常重要,GAPDH通过连接T细胞效应功能和葡萄糖的可用性,起到代谢检查点的作用。事实上,在缺乏底物的情况下,GAPDH会干扰IFN-γ在TH1细胞中的翻译。重要的是,糖酵解过程中涉及的大多数酶,如GAPDH,都可以进入细胞核,并发挥其他功能,直接影响细胞增殖相关因子的转录和稳定性。脂肪酸的合成也通过提供脂质供应对T细胞增殖和分化发挥重要作用。脂肪酸合成也参与和T细胞激活有关的蛋白质的翻译后修饰。例如,肉豆蔻酰化是影响蛋白质-脂质相互作用和影响蛋白质细胞定位的过程,是TCR信号进行下游事件的必要条件。因此,TFs的脂依赖的修饰有可能会影响它们的细胞定位,如核易位,在那里它们可以启动特定的转录程序。尽管T效应细胞具有高度的糖酵解性,但Sena等人证明,它们的激活和增殖完全可以通过功能性线粒体代谢来维持。线粒体也支持T细胞的激活,其可以通过调节其胞质钙(Ca2+)来支持TCR相关事件。也有研究表明,线粒体的生物发生在T细胞激活时上调。因此,线粒体重塑和线粒体代谢的增加可以支持T细胞激活后细胞的生长和增殖。
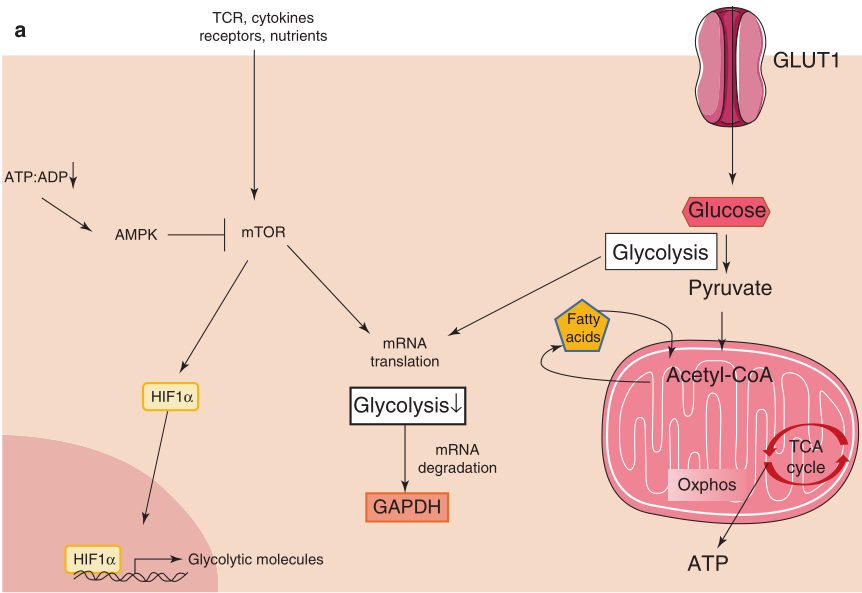
Fig 5.2 代谢状态和T细胞分化。(a)代谢状态和基因表达的整合:mTOR凭借环境信号借助T细胞中的受体(TCR、共刺激受体和细胞因子受体)通过激酶依赖途径激活。
5.3.2 控制T细胞分化的代谢检查点和途径
T细胞必须满足一定的代谢条件才能正常分化。因此,关键的代谢调节剂如mTOR和AMPK帮助细胞感知其代谢状态,控制激活和分化是否发生以及如何发生。此外,脂质代谢的调节在T细胞分化中也起着重要作用(Fig 5.2a)。
mTOR蛋白整合了表明营养物质和细胞生长和分裂必需因子存在的信号,并将它们与适合的代谢过程联系起来。重要的是,遗传或药理学mTOR抑制会损害效应T细胞分化。事实上,mTOR的活性似乎通过S6 K2的表达来支持TH17的发育,S6 K2与RORγt结合并促进其在细胞核内的运输。到目前为止,大多数研究证实mTOR是TH17分化的先决条件,但其对其他T细胞的影响尚不清楚,并且可能具有实验模型依赖性。而在体外,缺乏mTOR表达的初始T细胞即使在缺乏外源性TGF-β的情况下也会自发发育Tregs,在体内,缺乏mTOR的小鼠会发生一般的自身免疫反应。通过观察发现Tregs的增殖需要短暂的mTOR抑制,这使得上面的悖论得到了澄清。在体外,Treg暴露在富含营养和细胞因子的培养基中,导致mTOR持续激活,进而导致型Treg的增殖。在体内,暴露于不断变化的微环境条件可能与mTOR活性的变化有关,从而使Tregs增殖。这一结果表明,塑造mTOR活性的环境信号调节了体内Tregs的代谢谱。此外,自噬是在营养胁迫条件下启动的一种自我降解的细胞内过程,通过影响mTOR信号传导来支持Treg的稳定性和生存能力。与具有自噬能力的Treg相比,由于atg7缺陷而不能进行自噬的Treg表现出谱系稳定性下降。过继转移后,atg7缺陷的Tregs失去了FOXP3的表达,并上调IFN-γ或IL -17的产生。这些缺陷与TCR信号转导后mTOR高度激活、c-Myc激活和糖酵解代谢上调有关,共同导致向效应T细胞分化的转变。重要的是,通过雷帕霉素对mTOR的抑制,细胞在过继转移时恢复了稳定性的缺失。数据显示,在TH9细胞中,自噬的遗传和药物抑制以独立于mTOR的方式增强了TH9细胞的分化。事实上,自噬的缺失导致TH9调控因子PU.1的稳定性增加。mTOR在短期效应和长期记忆CD4+T和CD8+T细胞分化过程中也影响到细胞命运。TH细胞中不对称的mTOR活性导致其中一个子细胞中mTOR复合体成员mTORC1活性降低,这与类似记忆的表型(如更高的寿命)相关。因此,这些发现表明,mTOR活性水平可以决定细胞在TCR刺激和细胞分裂后,是否会在较早的时间点发展为效应或记忆表型。
AMP活化蛋白激酶(AMPK)在应对营养短缺或其他生理应激时被激活,使AMPK成为细胞能量水平的重要传感器 (Fig 5.2a)。使用AMPK激活剂二甲双胍的研究表明,暴露于该化合物后,TH1/ TH17分化受损。尽管有这些发现,但在正常代谢条件下,AMPK对于T细胞分化似乎并不是不可或缺的,因为缺乏功能AMPK的T细胞仍然能够获得效应功能。考虑到T细胞暴露在高度可变的微环境中,这些发现表明AMPK可以作为抗次优环境条件的屏障。此外,记忆性T细胞的生成依赖于AMPK,因为AMPK缺陷的CD8+ T细胞在第二次接触抗原后,其群体扩张能力存在缺陷。
脂质生物合成途径也影响T细胞的分化。在糖酵解过程中,生成的乙酰辅酶A产生新生FAS。FAS是一种促进细胞增殖的合成代谢过程,而脂肪酸也可以被称为脂肪酸β-氧化(FAO)的分解代谢过程所使用。活化后,T细胞从FAO转换为FAS。因此,抑制FAS可抑制CD4+ T和CD8+ T细胞的增殖。抑制T细胞中的新生FAS会损害TH17和TH1的分化,而Treg的发育会增强。此外,在TH17培养条件下,阻断FAS甚至会诱导TH17向Treg诱导转变。进一步的研究表明,抑制TH17细胞中的FAS导致RORγt的核定位改变,并降低了该TF与Il17a位点增强区域的结合。有趣的是,细胞的脂肪酸和胆固醇组成被证明可以调节RORγt与不同基因启动子的结合,如Il17和Il10。
5.3.3 代谢状态与T细胞分化
Treg和记忆T细胞的代谢表型与初始T细胞相似。据报道,与效应T细胞相比,体外分化的Tregs糖酵解较少,更依赖FAO和氧化磷酸化(OXPHOS) (Fig 5.2b)。与效应T细胞不同,记忆T细胞不增殖,并且很少产生或不产生细胞因子,通常表现为分解代谢,主要依赖于葡萄糖和脂肪酸的氧化。然而,记忆T细胞有几个特征,这些特征使它们在代谢上有别于初始T细胞。例如,CD8+和CD4+记忆T细胞的线粒体含量增加,CD4+ T细胞亚群的糖酵解潜能也增强,如GAPDH的胞浆浓度升高。有趣的是,记忆CD8+ T细胞同时参与FAS和FAO。一般来说,防止这种徒劳的循环是为了防止能源的浪费。记忆T细胞可能会激活这两个过程,以确保在再次刺激时立即适应新陈代谢。补充性研究表明,在CD8+T细胞应答过程中,对效应CD8+T细胞代谢谱的调控也会影响效应细胞和记忆亚群的分化。抑制效应型CD8+T细胞的mTOR活性可以抑制干扰素γ、颗粒酶B和穿孔素等效应分子的产生。BCL-6是一种记忆T细胞相关的转录因子,已被证明能够抑制CD4+或CD8+效应T细胞中的糖酵解分子编码基因,这为记忆形成过程中观察到的代谢变化提供了转录联系。因此,在多种情况下,促进线粒体脂肪酸氧化或抑制糖酵解可产生寿命更长并且抗原记忆性更好的CD8+T细胞;相反,促进糖酵解则会促进CD8+T细胞向效应形式转变 (Fig 5.2b)。
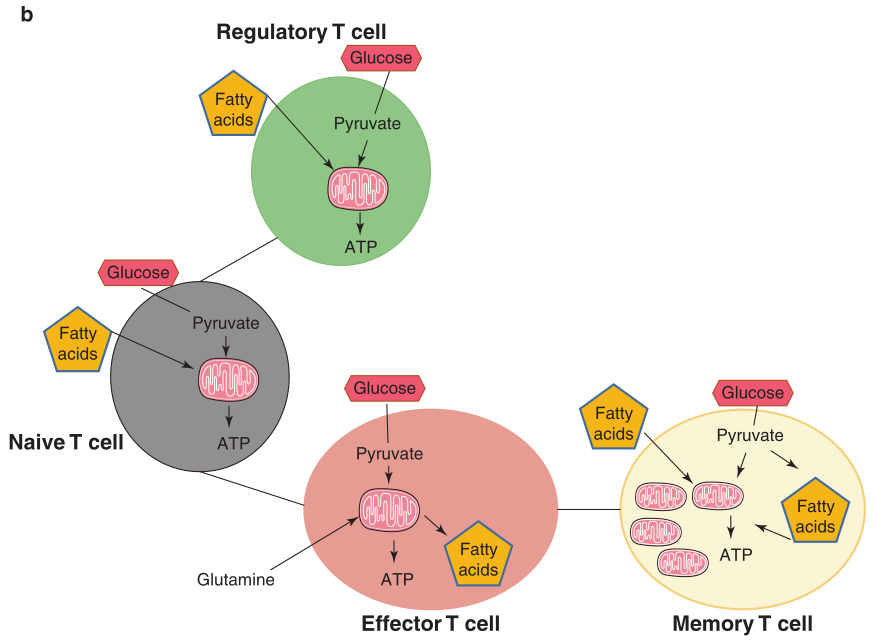
Fig 5.2 代谢状态和T细胞分化。(b)不同的T细胞亚群及其主要代谢特征:Treg和初始T细胞具有相似的代谢特征,大多数葡萄糖和脂肪酸在线粒体中被完全氧化以生成ATP。
— THE END —
▉ 往期文章目录
基础免疫学系列
肿瘤免疫学系列
肿瘤免疫学-第3章:CD8+ T细胞在免疫治疗、放疗和化疗中的作用(下)
肿瘤免疫学-第3章:CD8+ T细胞在免疫治疗、放疗和化疗中的作用(上)
生信入门学习笔记系列
基础实验技术系列
Annexin V/PI染色检测细胞凋亡-OncoLab实验室
仪器操作系列
蔡司LSM800激光共聚焦显微镜操作视频-中西医结合基础研究中心
IN Cell Analyzer2200高内涵细胞成像分析系统操作教程-中西医结合基础研究中心
文献分享系列
年度巨献:神刊CA发布最新癌症数据:全球1000万人死于癌症,中国占比超3成
HLA-I分子加工和递呈抗原功能受损是免疫检查点抑制剂耐药的重要原因
作图投稿选刊系列
GraphPad+AI制作可发表级别的柱状图-OncoLab实验室
PubMed中如何按影响因子筛选检索结果并显示影响因子及分区?
如何使用EndNote软件插入参考文献(附6813种杂志参考文献格式文件)
中医中药系列

关注本号~

加入读者交流群~
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏