11.1 介绍
骨髓源性抑制细胞(MDSCs)是一类发挥免疫抑制功能的髓系细胞。
MDSCs不同于巨噬细胞、树突状细胞(DC)或中性粒细胞等终末分化的髓样细胞,它是在骨髓中产生的造血细胞,并可分为两种亚型—单核MDSCs与多核MDSCs。单核MDSCs来源于巨噬细胞/DC前体细胞,而多核(PMN)MDSCs来源于髓系分化的粒细胞。
在人类和老鼠身上都可以发现这两种亚型。在人类中,M-MDSCs的特点是表达CD14、CD11b和CD33基因,而谱系标志物和HLA-DR呈低表达。PMN-MDSCs表达CD15、CD11b和CD33,而谱系标志物和HLA-DR表达呈阴性。
通过不同的密度可以区分PMN-MDSC和PMN(粒细胞)。
虽然研究发现许多标记物能进一步鉴定MDSC,但还没有一个标记被认为是特异性的MDSC标记。最近Dmitry Gabrilovich研究小组证明,LOX1标记可以区分人类的PMN-MDSC和PMN。
在小鼠身上,则用不同的分子描述MDSCs群。通过识别CD11b和Gr-1可以区分MDSC的两个亚群。
Gr-1是Ly6C和Ly6G两个标记的组合。利用这些标记可以更准确地分离MDSC群,M-MDSCs为Ly6C+和Ly6G,而PMN-MDSCs为Ly6G+和Ly6C。
我们几乎无法在健康个体中检测到MDSCs。但是在某些情况如急性感染(脓毒症)、慢性感染(结核病)或癌症中却可以检测到MDSCs的积聚。
如肿瘤细胞分泌的GM-CSF、G-CSF、SCF或S100A8、S100A9等因子便可使得MDSCs增殖。
MDSCs主要在肿瘤患者的肿瘤和次级淋巴器官中存在,一些研究也已经观察到在骨髓中也存在MDSCs的聚集。
在人类和小鼠中的多数癌症中的大部分MDSCs是PMN-MDSCs。MDSCs可通过多种方式促进肿瘤的生长和转移。
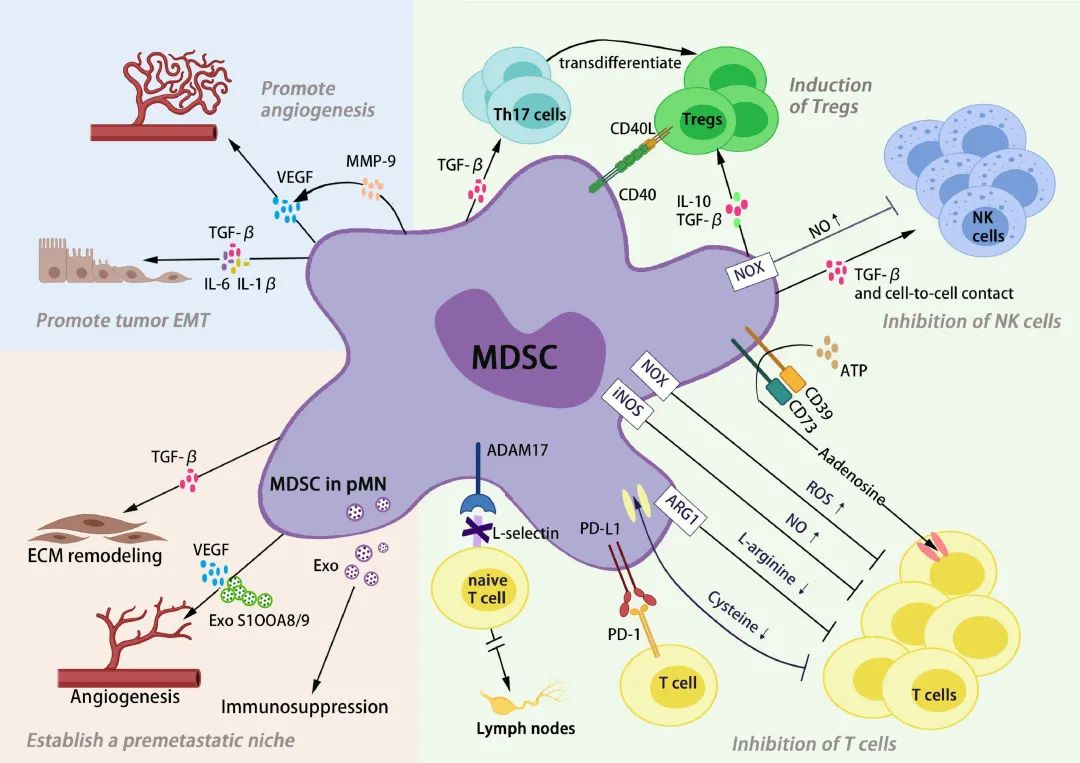
MDSCs可帮助建立有利于肿瘤生长的微环境,这要归功于它们能够产生促血管生成的介质,如VEGF、bFGF、MMP9或PDGF等分子,这些分子对新血管的形成很关键,而新血管对维持肿瘤生长至关重要。
MDSCs在肿瘤转移的启动过程中也起着重要作用。一项研究表明,在肿瘤细胞转移至肺之前的2周内,携带乳腺癌的小鼠的肺中MDSCs数量就已经增加,其增加依赖于Mmp9的产生。原发肿瘤诱导器官表达的促炎症蛋白S100A8和S100A9,可吸引MDSCs进入转移前的生态位(ps:广泛转移之前可由原发肿瘤部位分泌的外泌体在其他部位预先形成的微环境)。当MDSCs在一个新的器官中积聚时,它们产生的S100A8和S100A9可以放大这一机制,有利于肿瘤细胞的迁移和转移。
最近的研究还显示,MDSCs还具有增强癌细胞干性的潜力,从而促进其上皮间充质转化(EMT),以促进转移。
除了促进肿瘤细胞的生长和转移外,MDSCs还能支持肿瘤存活,这要归功于它们的免疫抑制特性。
MDSCs通过多种机制发挥免疫抑制作用。
MDSCs可产生IL-10和TGF-β并诱导调节性T细胞(Treg);它们还会产生活性氧,如O2−和H2O2和NO。
MDSCs由于表达Arg1,或由于其吲哚胺2,3-双加氧酶(IDO)活性而降低可用色氨酸水平,从而减少TCR的形成,并通过耗尽L-精氨酸环境而诱导T细胞周期停滞。
M-MDSCs和PMN-MDSCs并不具有完全相同的免疫抑制机制。M-MDSCs比PMN-MDSCs具有更高的免疫抑制活性,M-MDSCs表达Arg1并产生IL-10、TGF-β和NO,PMN-MDSCs则倾向于产生较多ROS(存在时间较短),这解释了为什么PMN-MDSCs比M-MDSCs抑制能力小。
在人类不同类型的癌症中,PMN-MDSCs和M-MDSCs之间的比例明显不同。
MDSCs是荷瘤动物和患者体内的主要免疫抑制成分之一。因此,MDSCs的消除或使其分化为有效的树突状细胞和巨噬细胞是免疫肿瘤学的一个主要问题。这样的策略可以增强抗肿瘤免疫力,让T细胞攻击肿瘤细胞,减轻肿瘤负荷。
我们将在这里集中讨论现有的各种减少MDSCs的方法,包括化疗和免疫疗法。
11.2 化疗对MDSCs的影响
一些化疗药物已被证明可以直接杀死MDSCs。
吉西他滨(Gemcitabine)是一种化疗药物,其含有胞苷的核苷类似物,起到抗代谢的作用,可用于治疗各种癌症,如卵巢癌、胰腺癌、肺癌、乳腺癌和胆管癌等。
2005年,Suzuki第一次证明了以吉西他滨为基础的化疗可以针对MDSCs。用相当于治疗人类病人的经典剂量治疗荷瘤小鼠的结果表明,吉西他滨可选择性地减少荷瘤小鼠脾脏中MDSCs的数量,而不影响CD4细胞、CD8细胞、NK细胞、巨噬细胞或B细胞的数量和功能。
吉西他滨可提高CD8+T细胞和NK细胞的抗肿瘤活性,且对小鼠脾脏的免疫抑制作用较小。然而,单独使用吉西他滨并未观察到对肿瘤生长的重大影响。
2009年,另一个使用不同肿瘤模型的研究小组证实了这些结果。除了发现脾脏中MDSC的百分比下降外,他们还观察到骨髓和外周血液中的MDSC的下降。治疗给药的动力学尤为重要。只有早期使用吉西他滨治疗才能延缓肿瘤生长,这表明代偿机制限制了已建立肿瘤中MDSC消耗介导的抗肿瘤效果。
多西紫杉醇和紫杉醇是临床上用于癌症治疗的紫杉醇家族药物。这两种药物都靶向微管蛋白,阻止微管解聚,从而阻止有丝分裂。
多西紫杉醇是一种常用的抗癌药物,在20世纪90年代主要用于治疗乳腺癌。现在紫杉醇被用来治疗各种癌症,包括肺癌、消化系统癌和卵巢癌等。
多西紫杉醇被证明对MDSCs有影响。携带乳腺肿瘤模型4T1的小鼠经多西紫杉醇治疗后,其脾脏中的MDSCs明显减少,CTL应答更高。MDSCs的减少部分是由于多西紫杉醇对PMN-MDSCs的细胞毒作用,而M-MDSCs分化为M1样表型。
后来发现M-MDSCs对多西紫杉醇具有耐药性,这主要因为它们分泌型/胞浆聚集素(sCLU)的表达,而sCLU的表达阻止了紫杉醇诱导的凋亡级联反应。
多西紫杉醇的类似物紫杉醇,细胞毒活性相对较弱,这种药物也主要用于肺癌、乳腺癌和卵巢癌的治疗。与未治疗的小鼠相比,小剂量紫杉醇治疗的荷瘤小鼠的MDSCs数量减少,但无细胞毒性作用。MDSC的减少是其分化为DC的结果,并未检测到MDSC细胞死亡。同一研究小组利用自发性黑色素瘤模型实验,结果显示低剂量的非细胞毒性紫杉醇可以减少MDSCs的积累及降低其免疫抑制活性(其余MDSC产生的TNF-α和S100A9较少)。
阿霉素(Doxorubicin)是一种属于蒽环类药物家族的化疗药物。它通过插入和抑制拓扑异构酶II与DNA相互作用,从而抑制DNA复制。
阿霉素通常用于治疗肉瘤、乳腺癌、白血病和非霍奇金淋巴瘤,并且已被证明能选择性地耗尽4T1乳腺癌荷瘤小鼠脾脏、血液和肿瘤中MDSCs。残留的MDSCs显示其抑制功能受损,ROS、精氨酸酶-1和IDO的产生较少,而CD4和CD8淋巴细胞和NK细胞的比例较高。
然而,最近的研究表明阿霉素也能诱导4T1细胞等癌细胞分泌前列腺素E2(PGE2)。前列腺素E2刺激MDSC的增殖和积聚,在荷瘤宿主中重建后续的MDSC群和免疫抑制。这些数据表明,蒽环类药物对MDSCs的作用可能截然不同。
曲贝替丁(Trabectedin)是一种细胞毒剂,它结合在DNA的小沟槽上,引起细胞周期的紊乱。
在不同的实验模型中,曲贝替丁导致血液、脾脏和肿瘤中的单核/巨噬细胞被选择性耗尽,并伴随着血管生成的减少。由于TRAIL受体(信号转导和诱导受体)的差异表达,曲贝替丁激活单核细胞髓系细胞中caspase8依赖的选择性凋亡,而不是中性粒细胞中caspase8依赖的选择性凋亡。这些数据显示出使用曲贝替丁靶向肿瘤浸润M-MDSCs的可能性。
局部放疗可改变肿瘤微环境,清除免疫抑制细胞。在CT26和MC38小鼠结肠癌模型中,高剂量辐射改变了免疫抑制的肿瘤微环境,增加CD8+T细胞肿瘤的浸润以及减少MDSC积聚。从机制上看,放疗诱导CD8+T细胞产生IFN-γ,控制了MDSCs在肿瘤中的存活和浸润,逆转了免疫抑制环境。
此外,抗肿瘤免疫CD8+T细胞可通过产生TNF-α、IFN-γ或表达FasL来杀伤MDSCs,从而减少MDSC在肿瘤中的浸润。相反,低剂量放疗对MDSCs数量无显著良性影响。
5-氟尿嘧啶(5-FU)是一种胸苷酸合成酶抑制剂,可以阻止DNA复制所必需的核苷胸苷的合成。这种抗代谢药物用于治疗大多数消化系统癌症,是治疗结肠癌的主要药物。
在几种小鼠肿瘤模型中,5-FU可以选择性地使MDSCs耗竭,包括PMN-MDSCs和M-MDSCs(Fig. 11.1)。MDSC的耗竭是由于5-FU治疗后触发细胞凋亡所致。5-FU之所以能选择性地杀死MDSCs,是因为MDSCs低表达5-FU靶酶(一种胸苷酸合成酶)。
5-氟尿嘧啶(5-FU)是胸苷酸合成酶的竞争性抑制剂,胸苷酸合成酶低表达的细胞对5-FU诱导的细胞死亡非常敏感。在荷瘤小鼠中,5-FU治疗显著延缓了肿瘤的生长,并诱导了肿瘤中特异性CD8T细胞的激活。
仔细观察5-FU对荷瘤小鼠免疫群体的影响,发现使用5-FU治疗10天后,Th17细胞数量增加,同时肿瘤恢复生长。Th17细胞的增加是由于死亡的MDSCs产生了IL-1β。
事实上,5-FU诱导MDSCs中BAX的激活和溶酶体的通透性增加。组织蛋白酶B蛋白从溶酶体释放到细胞质中,与NLRP3相互作用,触发NLRP3炎性小体的形成和激活,产生裂解的、具有生物活性的IL-1β。然后,IL-1β将促进CD4 T细胞的Th17极化。经5-FU处理的MDSC体外刺激CD4T细胞可促进其产生IL-17的能力。
在体内,5-FU以NLRP3依赖的方式诱导荷瘤小鼠Th17细胞聚集。有趣的是,IL-17促进了血管生成,而这种新血管生成似乎是5-FU有害效应的重要影响因素。
IL-1的可溶性受体IL-1RA与5-FU联合使用可阻断IL-1β的作用。这种治疗减少了Th17细胞的生成和新生血管的生成,并显著提高了5-FU对抑制肿瘤生长的作用。
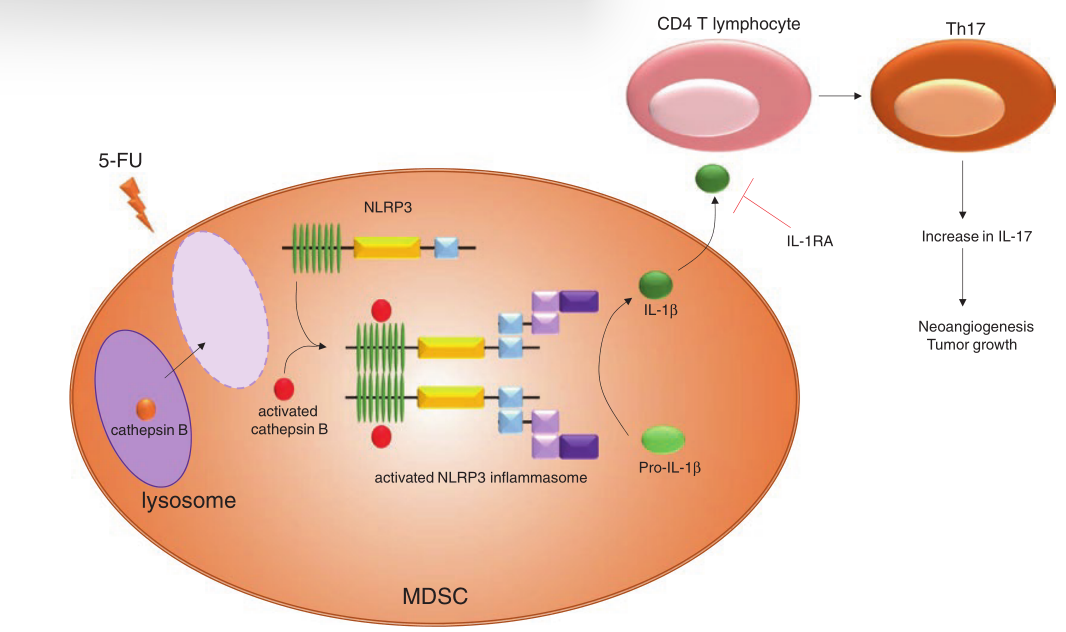
Fig. 11.1 :5-FU依赖的MDSCs耗竭。5-FU特异性靶向和消耗MDSCs,降低整体免疫抑制。然而,5-FU也能诱导MDSCs溶酶体的通透性增加。然后,组织蛋白酶B可以从溶酶体进入细胞质,与NLRP3相互作用,诱导NLRP3炎症小体的形成和激活。激活的NLRP3炎症体将前IL-1β裂解为活性IL-1β,激活CD4T细胞产生更多IL-17,促进新血管生成和肿瘤生长。
化疗对骨髓间充质干细胞的影响往往是一把双刃剑,肿瘤细胞和免疫抑制性免疫细胞擅长寻找漏洞,从而恢复免疫抑制性肿瘤环境,如图所示。我们应该小心,不要在未知全貌之前做出任何过早的结论。
11.3 化疗对人MDSCs的影响
关于化疗对MDSCs影响的人体研究有时会显示出相互矛盾的数据。
在胰腺癌患者中,首次显示5-FU和吉西他滨降低了约40%的患者的MDSCs百分比,并且当与使用GM-CSF作为佐剂的GV101疫苗联合使用时,大多数患者的MDSC百分比降低。但是,一些患者的MDSC数量确实升高了,这与促炎细胞因子的增加有关。
这些结果与最近的一项研究相吻合,在该研究中,吉西他滨或5-FU治疗与肿瘤细胞分泌的GM-CSF上调有关,由此诱导MDSCs向单核细胞分化。
相反,吉西他滨和5-氟尿嘧啶联合细胞因子诱导的杀伤细胞的免疫治疗时,观察到对MDSCs有积极作用。
在转移性肾细胞癌和胰腺癌中,这种化疗结合免疫疗法的使用成功地减少了患者外周血中MDSCs的数量,延长了生存时间。
有趣的是,在结直肠癌患者中,5-FU治疗的阳性或阴性结果取决于与5-FU联合使用的类型。
事实上,5-FU并不是单独用于结直肠癌。5-FU与叶酸和奥沙利铂(FOLFOX)联合使用被证明是有益的,可以降低总体免疫抑制和MDSC百分比,而5-FU与叶酸和CPT11(FOLFIRI)联合使用则是有害的,甚至增加了患者中MDSCs的数量。
在另一项测试FOLFOX联合贝伐单抗(一种抗VEGF-A抗体)对转移性结直肠癌一线治疗患者MDSCs影响的研究中,作者观察到25名患者中有15名PMN-MDSCs下降。
由于癌症化疗总是与几种药物联合在一起,因此研究这些联系的效果是至关重要的。
11.4 酪氨酸激酶抑制剂
除了细胞毒性化疗外,还研究了其他几类抗癌药物阻止MDSC的增殖或促进其分化的能力。
酪氨酸激酶抑制剂(TKIs)是一组针对不同途径的酪氨酸激酶的分子。靶向调节 RAS-RAF/MAPK通路、PI3K/AKT/mTOR 通路和EGFR通路,参与调节细胞的存活、增殖、分化和迁移以及血管生成。这些途径的突变经常在癌症中被发现,这解释了为什么关于TKI的研究在过去几年有快速且持续的发展。TKIs对MDSCs的潜在影响引起了越来越多的关注。
舒尼替尼(Sunitinib)是一种针对多种受体酪氨酸激酶(RTKs)的TKI,包括VEGF-R1和VEGF-R2,PDGF-Rs,也包括c-kit。它于2007年被FDA批准用于治疗晚期肾细胞癌(RCC),目前用于RCC的一线治疗。
在肾癌中,舒尼替尼通过影响MDSC的存活率和增殖来逆转MDSC的积聚。MDSC的减少与CD3细胞产生IFN-γ的增加有关。舒尼替尼可减少MDSCs和Tregs的数量,减少免疫抑制细胞因子IL-10、TGF-β的产生。
有趣的是,经舒尼替尼治疗后,CD4和CD8T细胞上负性共刺激分子CTLA-4和PD-1的表达减少。舒尼替尼可抑制单核MDSC的增殖,同时诱导粒细胞MDSC亚群凋亡。
然而,肿瘤内MDSC的数量和功能不受舒尼替尼的影响,因为在肿瘤中产生的大量的GM-CSF以STAT5依赖的途径保护MDSCs。
据报道,舒尼替尼还可以影响MDSCs以外的其他细胞类型,因为可以观察到中性粒细胞和单核细胞的百分比降低,而淋巴细胞的百分比增加(Fig 11.2)。
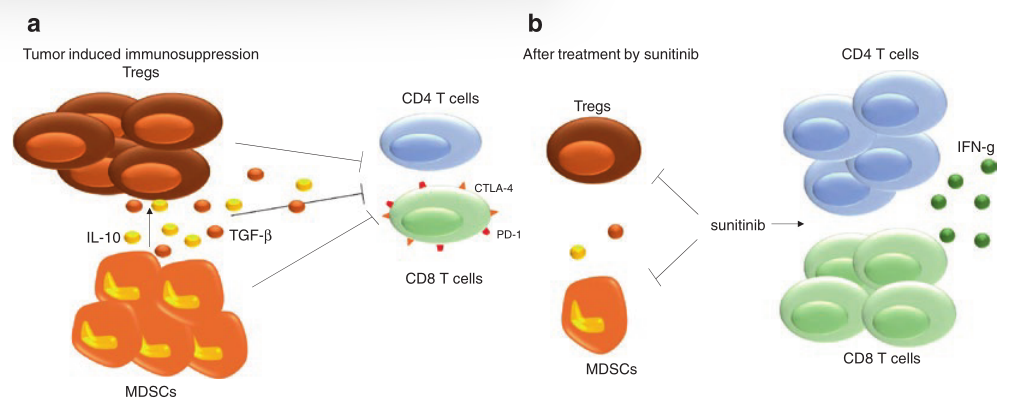
Fig. 11.2 :舒尼替尼的免疫效果。Sunitinib是一种针对VEGF-Rs和PDGF-Rs的TKI,通过降低MDSC的活性和增殖来抑制MDSC的聚集。舒尼替尼还可靶向Tregs,减少IL-10和TGF-β的产生,同时促进CD4和CD8T细胞的增殖,增加 IFN-γ的产生。
而使用另一种VEGF通路抑制剂贝伐单抗(抗VEGF-A单抗)的研究表明,MDSCs是导致抗VEGF治疗临床效果不佳的原因,但贝伐单抗对MDSC的活性或分化没有影响。
后来的另一项研究证实了这一点,该研究表明贝伐单抗治疗不会降低MDSCs的百分比,也不会改变其精氨酸酶-1的表达水平。但是在非小细胞肺癌患者中,三个周期的贝伐单抗联合化疗方案可以以贝伐单抗依赖的方式减少PMN-MDSC的数量。
贝伐单抗对MDSCs的影响仍有待证实,观察到的差异可能是用于治疗癌症的其他药物的结果,也可能是由于肿瘤类型的不同。
索拉非尼(Sorafenib)是一种针对多种激酶的抑制剂,其中包括C-RAF、BRAF、VEGF-R2和VEGF-R3。
索拉非尼在小鼠肝癌模型中首次被证明能够减少Tregs和MDSCs,同时减缓了肿瘤的生长。此外,索拉非尼能降低MDSCs对CD8T细胞的抑制,而另一种抑制剂舒尼替尼则不能。
对不同剂量的不同给药方案进行了测试,重复小剂量的索拉非尼似乎通过减少MDSCs和Treg细胞数量,以及通过减少IL-10或TGF-β等免疫抑制分子的表达来增强过继T细胞治疗的疗效。
在选择剂量的同时,还应考虑治疗的动力学,因为索拉非尼可以降低单核细胞来源的MDSC的比例,但不影响已经分化的MDSCs。
然而,索拉非尼的作用可能并不局限于MDSCs。索拉非尼在IL-2或IFN-α刺激后降低了T细胞、B细胞、NK细胞、Tregs和MDSCs中STAT1和STAT5的磷酸化。
这些数据表明,索拉非尼可能会对适应性免疫反应的效应细胞产生有害影响。在使用索拉非尼耗竭MDSCs时,我们可能应该牢记这些数据。
针对c-kit和BCR-ABL,伊马替尼(imatinib)是第一个被批准用于慢性粒细胞白血病的TKI。
伊马替尼有效抑制MDSC增殖和精氨酸酶-1表达。然而,关于它对其他免疫细胞群体的影响,各种报告也提到了相互矛盾的结果。
伊马替尼被证明可以削弱Tregs免疫抑制功能,恢复浆细胞样树突状细胞功能,并抑制肿瘤诱导的CD4+T细胞耐受。
另一方面,伊马替尼治疗也被证明可以阻止经抗原活化后CD8T细胞的扩增,而不影响主要的T细胞和B细胞的反应。
达沙替尼(Dasatinib )是第二代化合物,用于对伊马替尼无效的慢性粒细胞白血病患者。与伊马替尼一样,达沙替尼阻断了MDSC的扩增,并且当与黑色素瘤模型中的DC疫苗联合时,可以引发广泛的肿瘤相关CD8+肿瘤浸润淋巴细胞的发育。
然而,在几项研究中,达沙替尼也以剂量依赖的方式抑制CD4+和CD8+T细胞的激活和增殖。
伊马替尼和达沙替尼对MDSCs的有益作用是明确的,但它们对T细胞的影响尚不清楚。
许多其他的TKI已被证明对MDSCs其增殖、分化以及其抑制功能有较大影响。
2011年,FDA批准维莫拉非尼(Vemurafenib)通过BRAF V600突变治疗不可切除或转移性黑色素瘤。维莫拉非尼可降低小鼠和人黑色素瘤中M-MDSCs、PMN-MDSCs和Tregs的比例和数量。使用维莫拉非尼治疗后,观察到肿瘤浸润性CD8T细胞增加,并且这与肿瘤缩小有关。
布鲁顿酪氨酸激酶(BTK)抑制剂依鲁替尼(ibrutinib)于2013年被FDA批准用于治疗一些B细胞淋巴瘤,它可以减少MDSC在肿瘤区域的积聚,并减少IDO的表达。这些效应很可能是抑制MDSCs中BTK的直接结果。
最近,人们对PI3K/AKT/mTOR通路对MDSCs的影响越来越感兴趣。肿瘤细胞和MDSCs的mTOR通路的激活似乎都有利于MDSCs。
事实上,mTOR抑制剂雷帕霉素(rapamycin)已被证明能显著降低荷瘤小鼠的MDSC数量和M-MDSC的免疫抑制的功能。mTOR似乎是影响MDSCs分化和抑制功能的内在因素。
此外,癌细胞中mTOR通路的激活也可能有利于MDSCs在人乳腺癌中以G-CSF依赖的方式募集和积聚。
然而,我们必须记住,mTOR激活也是T细胞激活所必需的,mTOR抑制剂可能会对CD8抗肿瘤免疫反应产生一些有害的影响。到目前为止,临床上仅有雷帕霉素衍生物用于阻断PI3K/AKT/mTOR通路,但其他针对该通路的抑制剂仍在开发中。这类药物也应该进行测试,以明确它们抑制MDSCs的功能或减少其数量的功能。
— THE END —
▉ 强烈推荐
▉ OncoLab实验室网站
本公众号上的往期文章同步发布至对应网站OncoLab实验室。
网站自带检索功能,可以根据关键词进行检索,并且可以根据日期及内容分类进行查看 ,大家可以收藏方便在电脑上查看。
网址是:oncolab.cn
▉ OncoLab学术导航
此外,梳理了一下这几年攒的收藏夹,做了一个导航网页,包含常用网站、文献阅读、试剂订购、基金相关、实用工具、常用数据库等分类内容,并且整合了百度、谷歌、必应三大搜索引擎到检索工具中,欢迎收藏或设置为主页使用~
网址是:dh.oncolab.cn
▉ OncoLab知识星球
OncoLab学术星球现已开通,在学习本公众号内容的过程中如果有什么需要讨论交流的地方可以在星球发表留言,也可以分享一下自己的学习心得体会,其他小伙伴看到了可以积极留言回复,我也会积极参与其中,并时常放一些学习资料在上面,希望大家能够在积极交流互帮互助中共同进步~
该星球用于OncoLab公众号读者交流学习使用,永久免费。

关注本号~

加入读者交流群~

加入知识星球~
用于OncoLab读者交流互助永久免费
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏