17.1 介绍
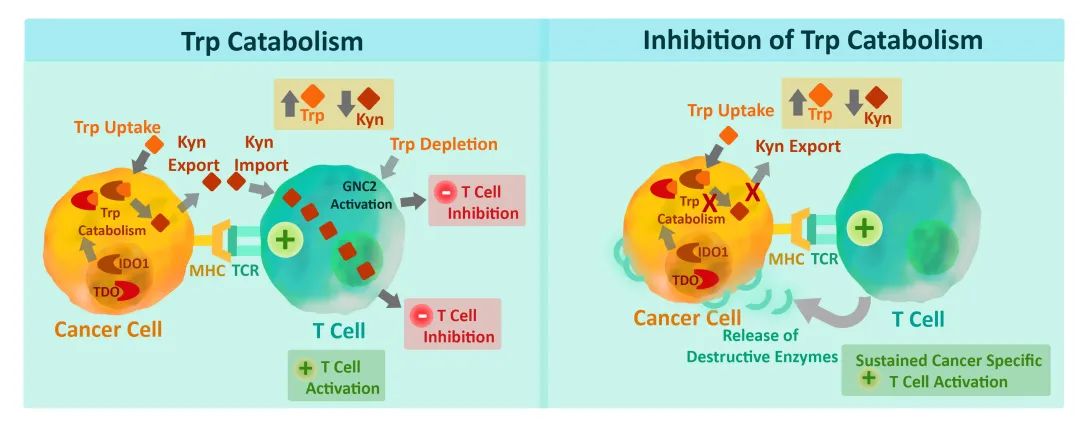
晚期癌症的一个普遍特征是色氨酸分解代谢增强,这种现象与肿瘤负荷有关。色氨酸是最稀有的氨基酸,在饮食中是必不可少的。因此,它的水平受到严格的控制,部分是由体内的5-羟色胺和犬尿氨酸途径的分解代谢所控制。
5-羟色胺途径在医学上具有十分重要的作用,其作用主要体现在调控情绪和肠道蠕动方面。然而,只有5%的色氨酸通过该途径进行代谢。
犬尿氨酸途径在色氨酸分解代谢中起主导作用,但人们对它的了解相对较少。而关于这一途径的研究主要集中在生物化学和神经学领域,神经学研究认为该途径产生的分解代谢物会导致心因性疾病的发生。在生物化学方面,IDO和TDO控制着色氨酸分解代谢的限速步骤第一步,即产生关键酶辅因子烟酰胺腺嘌呤二核苷酸(NAD)。然而,为了满足代谢需求,饮食中NAD会被清除,导致犬尿氨酸途径的生理需求似乎并不不能得到很好的满足。
长期以来,由 TDO2 基因编码的 TDO 被认为是调节膳食中色氨酸分解代谢的主要肝酶。相比之下,IDO是一种更广泛表达的诱导型酶。20世纪60年代,编码IDO的IDO1基因作为第一个干扰素激活基因被发现。尽管在传染病领域也进行了一些相关的研究,但这种联系在当时并未得到足够的重视。
1998年,在Munn、Mellor和他们同事的开创性工作中,他们将IDO与妊娠期间T 细胞定向免疫抑制联系起来,这是关于色氨酸分解代谢的生理意义的关键概念性突破。
简而言之,他们提出,在IDO活跃的微环境中,色氨酸的缺乏会损害抗原依赖性T细胞的激活。支持这一概念的初步证据是,IDO途径抑制剂1MT能够逆转怀孕小鼠对外来父源抗原的免疫耐受,该药物可诱导MHC限制性T细胞介导的同种异体排斥反应。
一些报告证实了IDO是癌症免疫耐受的一种重要媒介。
首先,IDO1的过度表达在人类肿瘤中普遍存在。正常情况下,IDO1处于肿瘤抑制因子BIN1(人类肿瘤中最常见的弱化表达的基因之一)的控制之下。因此,癌细胞中IDO的升高可以直接归因于肿瘤抑制功能的破坏,在恶性进展过程中,抑制功能的破坏则更加严重。
在具有免疫活性的小鼠癌症模型中,使用一定剂量1MT引起的受孕排斥反应显示出有限的抗肿瘤作用。然而,同样剂量的1MT通过一种依赖于CD4+/CD8+T细胞的途径作用后,极大地增强了免疫原性化疗治疗的效果,显示出良好的应用前景。
如下所述,1MT的D和L外消旋体在体内通过复杂的作用机制起作用,这在很大程度上不同于系统的IDO1酶抑制(特别是在D-1MT的情况下,采用Indoximod的命名进行临床试验)。Muller, Prendergast和他们的同事之后发现了一种生物活性的IDO1酶抑制剂,它可以使化疗效果类似于1MT,这提供了第一个支持这一概念的治疗性证据。
临床前药理学验证是通过研究其他结构上不同的生物活性IDO1酶抑制剂实现的,其中最值得注意的是苯咪唑和羟胺类化疗药物,临床先导药物NLG919/Navoximod 和INCB024360/epacadostat分别是从这些化疗药物中开发出来的。对IDO1缺陷小鼠的遗传学研究巩固了其能够作为癌症治疗靶点的临床前验证。
总体而言,在这些成果的帮助下,我们能够将IDO1确立为免疫逃逸的关键介质,而免疫逃逸是癌症的关键特征。
目前,临床先导剂D-1MT/吲哚莫德、INCB024360/epacadostat和NLG919在人体试验中进展最快。
在本章中,我们总结了支持IDO/TDO酶作为炎症调节剂的证据,它不仅与适应性耐受有关,而且与肿瘤新生血管和转移有关;
总结了吲哚莫德、艾卡哚司他和NLG919作为临床先导化合物在该领域的发现和发展;
以及TDO抑制剂和IDO/TDO混合抑制剂的原理和正在进行的探索,其依据是TDO和IDO2在推动癌症进展中的更广泛的理论基础,以及它们在IDO1旁路(固有耐药)和获得性耐药中的潜在作用。
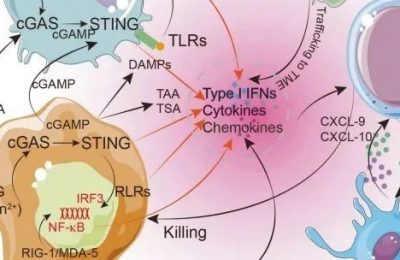
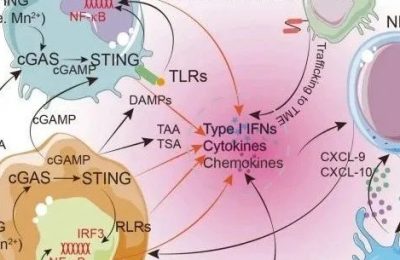
IDO1选择性抑制剂目前处于临床开发的前沿,是癌症相关炎症和适应性免疫的一种独特的免疫代谢调节剂。Fig. 17.1提供了关于IDO/TDO酶在癌症中的表达部位和功能范围的一般观点,如下所示。
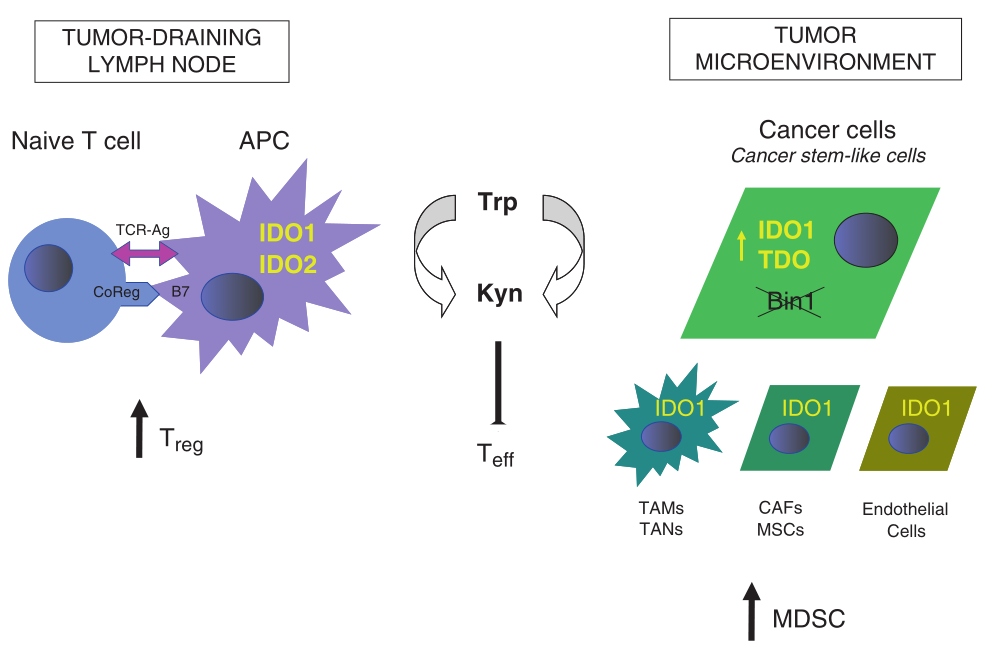
Fig. 17.1 IDO/TDO在肿瘤中的表达和作用部位。IDO1、IDO2和 TDO在肿瘤微环境(包括转移部位)和肿瘤引流淋巴结(TDLN)的各种细胞中都有表达,包括在肿瘤、间质、血管和免疫细胞中。由IDO1和TDO介导的色氨酸剥夺和犬尿氨酸的产生都与炎症过程和免疫逃逸(抗原耐受)有关。上图还展示了IDO/TDO活性对T细胞和MDSC功能的影响。APC,抗原提呈细胞(如树突状细胞);MDSC,骨髓源性抑制细胞;TAM,肿瘤相关巨噬细胞;TAN,肿瘤相关中性粒细胞;Teff,效应T细胞;Treg,调节性T细胞。
17.2 IDO1在T细胞免疫逃逸中的作用
癌症生物学家普遍认为肿瘤细胞的固有特征具有决定性的重要意义,这一观点被概括在一个极具影响力的癌症特征分类中。
在这个普遍的概念中,转移和血管生成这两个公认的明显依赖宿主的特征是从以肿瘤为中心的角度来考虑的,而没有考虑到肿瘤与宿主免疫的相互作用也可能在癌症预后中发挥重要作用。
在2008年的一篇综述中,首次将免疫逃逸纳入了肿瘤关键关键特征,并提出IDO1与这种免疫逃逸相关。这一观点最终被普遍接受,因为该观点考虑到了宿主环境因素(如免疫和炎症)的重要性,重新评估了肿瘤的关键特征。
在DC和巨噬细胞中诱导IDO1来促进免疫耐受是通过抑制效应性T细胞,将幼稚T细胞转化为FoxP3+Tregs,以及提高“天然”Tregs的抑制活性来实现的。
肿瘤外IDO1的诱导最初是在一组癌症患者和临床前肿瘤移植模型中报道的。在小鼠B16黑色素瘤模型中,IDO1不能直接在形成的肿瘤中检测到,而是在TDLN中升高,定位于具有T细胞抑制活性的DC特定亚群附近。
几种不同的IDO1抑制化合物已经被鉴定出来,它们可以显著抑制B16肿瘤生长,这种抑制依赖于完整的T细胞免疫和宿主IDO1功能,这为IDO1在限制抗肿瘤免疫中的瘤外作用提供了药理学支持。
以同样的方式,对IDO1参与推动原发肿瘤发展的第一个遗传学验证来自于对经典的两期皮肤癌发展模型的研究,在这些模型中,没有证据能表明IDO1在发展中病变中表达;与B16模型相似,IDO1在TDLN内的树突状细胞(DC)中的表达和活性显著升高。
在这种情况下,肿瘤的发生和发展是明显分开的,IDO1在促进肿瘤的炎症环境中升高,即使在没有肿瘤形成的情况下也是如此,这清楚地表明肿瘤外的IDO1升高是在启动促瘤致瘤的炎症微环境编程之前就发生的早期事件。
17.3 炎症编程中的IDO1:MDSC的产生和转移
依赖于IDO1支持的骨髓源性抑制细胞(MDSC)是建立免疫抑制肿瘤微环境的另一个关键因素。MDSC是一组未成熟的骨髓源性造血细胞,其功能取决于其抑制T细胞活性的能力。
接收炎症信号后,MDSCs迁移到淋巴、脾和肿瘤组织,以产生局部免疫抑制。在MDSC发挥其T细胞抑制作用的机制中,有证据表明IDO1活性是一个关键因素。
这种联系在对IDO1−/−小鼠新生肺癌和转移模型的遗传学研究中首次被发现。IDO1−/−小鼠能抵抗肺肿瘤的生长,而从荷瘤动物获得的MDSC对于CD8+和CD4+ T细胞的抑制是减弱的。
此外,IDO1缺失可导致MDSC的主要驱动力IL-6的减弱,而且IL-6的异位表达足以逆转IDO1−/−小鼠中MDSC导致的T细胞抑制活性的降低和对肺转移的抵抗能力。因此,IDO1通过影响炎症环境对MDSC的抑制功能发挥调控作用。
其他研究表明,肿瘤的MDSC募集需要IDO1。虽然IDO1在支持MDSC功能中起到关键作用,但值得注意的是,在小鼠模型中没有令人信服的证据表明IDO1直接在MDSC中表达。相反,人类研究已经确定了表达IDO1的MDSC群体,并将这些细胞中IDO1的表达与免疫抑制功能联系起来。
总体而言,除了调控MDSC的功能和募集外,IDO1还可以通过其他机制来支持MDSC的活性。
17.4 炎症编程中的IDO1:病理性血管新生与肿瘤转移
新血管生成对支持肿瘤生长的重要性已得到充分证实。
虽然血管生成(angiogenesis)有时被用来泛指所有血管的发育,但它的特定含义是从先前存在的血管网络中形成新的血管,而血管建成(vasculogenesis)指的是通过募集新的细胞(如骨髓来源的内皮前体细胞)形成血管。血管建成主要与胚胎血管发育和成人血管生成有关,但情况可能更复杂,这两个过程之间的区别可能不是绝对的。血管建成(vasculogenesis)和血管生成(angiogenesis)的结合涉及从中胚层和内胚层起源的器官的血管形成,如肺、心、胰腺和肝脏,而外胚层起源的器官,如脑、肾、胸腺和肢芽,血管生成似乎占主导地位。
重要的是,这些观察表明,在不同的组织环境中,形成新血管的过程可能不同,这可能是影响肿瘤生长和在体内不同部位转移的一个因素。
血管新生是指视网膜和肺等组织中因缺血而导致的血管过度且无序的生长。新生血管也是正在生长的肿瘤的一个显著特征。在实验性的缺血模型中,免疫细胞被报道在修剪多余的血管和限制新生血管方面发挥重要作用,这表明免疫可能在肿瘤中也发挥着重要的抗新生血管作用。
特别是炎症细胞因子干扰素γ已被证明能触发抗新生血管活性,导致肿瘤细胞死亡。在一系列研究中,干扰素γ介导的血管清除被认为是CD4和CD8 T细胞依赖的肿瘤排斥反应的主要机制。
然而,炎症是一个复杂的过程,也可以促进新生血管的形成。特别是,炎性细胞因子IL6已被证明对缺血诱导的新生血管非常重要,并已被证明可通过不依赖血管内皮生长因子的信号过程促进异常血管生成。
IL6通常也被认为是促肿瘤的,而干扰素γ则被认为是抗肿瘤的。这表明炎症环境中的细胞因子平衡很可能通过影响新生血管来影响肿瘤生长。
在此背景下,发现IDO1的缺失导致肺血管形成减少,并由此提出假设,即干扰素γ诱导IDO1可能以负反馈方式发挥作用,从而限制干扰素γ的抗血管生成作用,这可能是IDO1对抗基于免疫的肿瘤生长限制的重要途径。
IDO1缺失还与炎性细胞因子IL6的诱导减弱有关,在肺转移模型中,IL6的异位表达可以削弱IDO1−/−小鼠对肿瘤转移的抵抗。根据这些发现提出了假设,从肿瘤发生开始,IDO1作用于干扰素γ的下游和IL6的上游,使炎症环境向血管生成和促进肿瘤生长的方向转变。
正如该模型所预测的那样,与野生型对照小鼠相比,IDO 1−/−小鼠肺转移瘤的新生血管显著减少。然而,由于IDO1−/−小鼠的整体转移性肿瘤生长也被显著抑制,所以尚不清楚血管形成的减少是否是IDO1缺失的直接影响。
为了验证IDO1对于支持血管新生十分重要这一观点是否被肿瘤微环境中其他混杂效应影响,我们对小鼠OIR(氧源性视网膜病变)模型进行了研究。OIR模型是一个成熟的、可重现的研究新生血管的替代系统。正如预测的那样,与WT小鼠相比,IDO 1−/−小鼠在OIR诱导的视网膜新生血管方面表现出显著的减少。而相关的IDO2亚型的缺失对OIR诱导的视网膜新生血管没有明显的影响,表明这种影响是IDO1所特有的。
IDO1−/−组和WT组在常氧条件下的正常视网膜血管形成没有差异,而IDO1−/−动物中正常血管再生形成的无血管区域减少更多,表明在缺乏IDO1的小鼠中,正常血管再生得到改善。
在缺乏IDO1基因的小鼠中观察到的OIR诱导的视网膜新生血管的减少是通过siRNA介导的IDO1在视网膜中的表达下调来实现的,表明IDO1缺失可以从局部和急性两方面引起对新生血管的影响。
同样,临床药物艾卡哚司他(epacadostat)对IDO1的药理抑制减少了全身给药时OIR诱导的视网膜新生血管。类似研究中,在肺转移模型中给予艾卡哚司他可迅速消除现有的新生血管,证实了这些发现在癌症环境中的潜在治疗可能性。
在确定了IDO1对支持新生血管的重要作用后,研究人员进行了测试,以验证IDO1通过整合炎性细胞因子干扰素γ和IL6之间的调节而产生这种作用的假设。
与IDO1主要通过对抗干扰素γ的抗血管生成活性来支持新生血管的假设一致,在 IFNG−/− IDO1−/−双基因敲除小鼠中清除干扰素γ可将OIR和肺转移模型中的新生血管水平恢复到野生型水平。
此外,正如预测的那样,IL6−/−小鼠在OIR和转移模型中显示出新生血管减少的现象,与IDO1−/−小鼠的观察结果相似。在IFNG−/− IL6−/−双基因敲除的小鼠中,IL6缺失对新生血管的影响同样因干扰素γ的清除而被逆转,这表明IL6的促血管生成活性很可能是因为从上游增强了IDO1对血管新生的促进。
在所有病例中,肺转移模型中的新生血管与总存活率密切相关,这表明对肿瘤新生血管的影响可能是IDO1抑制剂治疗的一个有意义的结果,应该作为这些药物正在进行的临床开发的一部分加以考虑。
17.5 B细胞炎症状态下的IDO2和IDO1的某些功能:联系和问题
尽管目前研究相对较少,但IDO2与IDO1在结构上相近,也参与色氨酸分解代谢调节免疫,特别是自身免疫。在小鼠和人类基因组中,IDO2基因位于IDO1的下游,结构研究表明IDO2具有更原始的功能。IDO2基因的缺失不会明显影响胚胎发育、造血或免疫特性,也不会影响血液中的色氨酸或犬尿氨酸水平。
IDO2酶的活性显然依赖于与IDO1不同的条件,例如,对生理助还原剂系统的不同要求。事实上,早先对IDO2“弱”活性的描述只是反映了非最佳的生化条件,改善条件后则产生明显的活性。因此,IDO2缺失对小鼠全身血液水平没有显著影响可能反映了相对于IDO1和TDO而言,IDO2表达的正常范围要窄得多,IDO1和TDO表达相对更广泛和更强烈。
小鼠遗传学实验证实了IDO2在免疫调节中的作用。IDO2缺陷小鼠的一个显著特征是缺乏支持IDO1诱导的调节性T细胞的能力。已有类似证据表明,人类树突状细胞对IDO2具有类似的耐受功能。IDO1基因缺陷小鼠也被发现存在IDO2功能的嵌合体缺陷,这加强了IDO1、IDO2相互作用在免疫控制中的线索。Fig. 17.2总结了IDO2的这一特征和一个模型,该模型表明了它在癌症中的潜在功能。有趣的是,在自身免疫性关节炎的模型中,吲哚莫德(D-1MT)的应用使得与IDO2缺失相关的疾病严重程度降低,这种治疗效果因IDO1缺失而消失,与吲哚莫德可以选择性地破坏IDO2酶的活性这一早期证据一致。然而,这些联系可能是与其上下游相关的,还有待在其他系统中扩展,例如可能与人类中IDO2降低色氨酸分解代谢活性的常见基因变异相关。
最近关于IDO2−/−小鼠对自身免疫性关节炎易感性降低的研究表明,IDO2在B细胞中发挥功能,支持B细胞炎症状态。这些发现很有趣,因为有证据表明,某些癌症的发展依赖于B细胞炎症状态。虽然IDO2缺乏的小鼠对炎症性皮肤癌的易感性没有变化,但它们抵抗K-RAS诱导的胰腺癌的发展(G.C.Prendergast和A.J.Muller,未发表的数据)。IDO2酶学与IDO1的不同之处在于需要不同的还原系统,尤其是对人类的酶,但最近对这些差异的阐明证实,IDO2具有明显的色氨酸分解代谢活性。虽然已经报道了鼠或人的IDO2小分子抑制剂,但它们没有生物活性,或者由于其他原因还没有在体内进行研究。有趣的是,最近报道了一种针对IDO2的B细胞穿透性生物活性抗体,该抗体在IDO2基因缺陷小鼠中具有抗关节炎作用。
在正常组织中,IDO2的表达范围比IDO1或TDO更窄,主要局限于肝、肾、脑、胎盘和B细胞、抗原提呈细胞(APC)。癌症并不倾向于过度表达IDO2,尽管在黑色素瘤以及胃、脑和胰腺肿瘤中都有报道,但后者的情况相较广泛。IDO2由芳烃受体(AhR)调节,该受体是由更活跃的IDO1酶产生的内源性配体,与犬尿氨酸结合。因此,给出IDO1-IDO2相互作用的线索,可以想象,局部IDO1活性可能会增加肿瘤微环境中流动的抗原提呈细胞中的IDO2水平,可能有助于肿瘤引流淋巴结(TDLN)中Treg形成的耐受状态。Fig. 17.2展示了一个模型,在该模型中,IDO2在IDO1/TDO下游的Kyn效应通路上发挥作用,以积极地参与TDLN中自身免疫或肿瘤时抗原免疫耐受的形成。
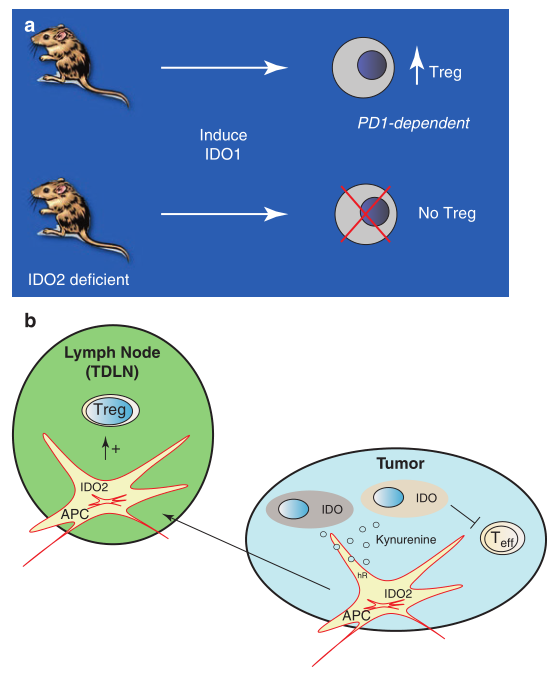
Fig 17.2 IDO2是IDO1介导免疫耐受的贡献者。 (a) IDO2缺陷小鼠在依赖PD1的IDO1介导的Treg诱导机制上存在缺陷,这支持了其他表明IDO1和IDO2在小鼠中存在遗传相互作用的证据。 (b) 模型。APC中由Kynurenine/AhR信号激活的IDO2表达可将IDO1在肿瘤和肿瘤间质细胞(蓝色肿瘤中的灰色或粉红色细胞)中产生的耐受信号远距离传播。局部表达IDO1钝化了由犬尿氨酸生产与色氨酸剥夺介导的抗原特异性效应T细胞。在APC中,IDO2的表达是通过IDO1介导的犬尿氨酸的产生而上调的,犬尿氨酸通过其受体AhR驱动APC中IDO2的转录。IDO2活性是由IDO1通过转录和转录后机制介导的。犬尿氨酸对APC具有耐受性,在该模型中IDO2作为效应器被激活。IDO2通过不同于IDO1可逆信号的不可逆信号增强APC的耐受性。由IDO2调控的APC游走到肿瘤引流淋巴结(绿色TDLN)或其他转移部位,加强了这些区域的IDO1依赖性Treg的形成(IDO1也在APC中表达,但为清楚起见未显示)。在IDO2缺乏的小鼠模型中,IDO2作为必需的中间功能发挥作用,并且该模型与Treg形成中研究IDO1功能的最新模型相兼容。
本文由Oncolab微信公众号翻译整理自Oncoimmunology: A Practical Guide for Cancer Immunotherapy,仅用于学习交流使用,如需购买原版书籍可点击阅读原文购买。
— THE END —
▉ 强烈推荐
▉ OncoLab实验室网站
本公众号上的往期文章同步发布至对应网站OncoLab实验室。
网站自带检索功能,可以根据关键词进行检索,并且可以根据日期及内容分类进行查看 ,大家可以收藏方便在电脑上查看。
网址是:oncolab.cn
▉ OncoLab学术导航
此外,梳理了一下这几年攒的收藏夹,做了一个导航网页,包含常用网站、文献阅读、试剂订购、基金相关、实用工具、常用数据库等分类内容,并且整合了百度、谷歌、必应三大搜索引擎到检索工具中,欢迎收藏或设置为主页使用~
网址是:dh.oncolab.cn
▉ OncoLab知识星球
OncoLab知识星球也已开通,在学习本公众号内容的过程中如果有什么需要讨论交流的地方可以在星球发表留言,也可以分享一下自己的学习心得体会,其他小伙伴看到了可以积极留言回复,我也会积极参与其中,并时常放一些学习资料在上面,希望大家能够在积极交流互帮互助中共同进步~
该星球用于OncoLab公众号读者交流学习使用,永久免费。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏