杂志名称:Cell Metab.
发表日期:2024.01.23
DOI:10.1016/j.cmet.2024.01.005.
PubMed:https://pubmed.ncbi.nlm.nih.gov/38309268/
影响因子:29.0
内容简介
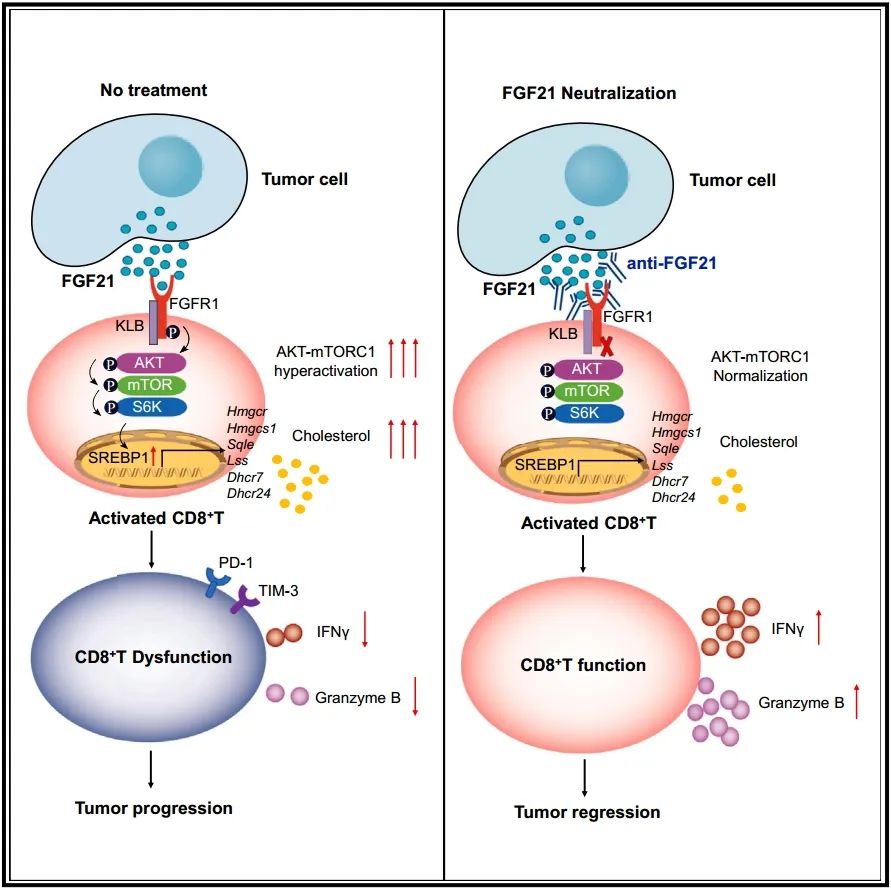
肿瘤采用多种策略来逃避免疫系统的攻击。揭示肿瘤抑制抗肿瘤免疫的机制有助于免疫疗法的发展。我们已经确定肿瘤分泌的成纤维细胞生长因子21(FGF21)是一个关键的免疫抑制剂。在多种类型的肿瘤中,FGF21表达上调,并促进肿瘤进展。肿瘤分泌的FGF21显著扰乱抗肿瘤免疫,通过重塑CD8+T细胞的胆固醇代谢。在机制上,FGF21维持激活的CD8+T细胞中AKT-mTORC1-固醇调节元件结合蛋白1(SREBP1)信号轴的高活性状态,导致胆固醇生物合成增加和T细胞耗竭。通过使用中和抗体降低FGF21表达或阻断FGF21可以使AKT-mTORC1信号正常化,并减少CD8+T细胞中过量的胆固醇积累,从而恢复CD8+T细胞的细胞毒性功能,并强有力地抑制肿瘤生长。我们的发现揭示了FGF21作为一个“分泌型免疫检查点”,阻碍抗肿瘤免疫,表明抑制FGF21可能是增强癌症免疫治疗效果的一个有价值的策略。
创新性及研究意义
这篇文章的核心创新性在于识别了肿瘤分泌的成纤维细胞生长因子21(FGF21)作为一个关键的免疫抑制因子。研究发现,FGF21在多种肿瘤中表达上调,并通过重塑CD8+T细胞的胆固醇代谢显著干扰抗肿瘤免疫反应。具体机制是FGF21维持CD8+T细胞内AKT-mTORC1-SREBP1信号轴的高活性状态,导致胆固醇合成增加和T细胞功能耗竭。通过降低FGF21表达或使用中和抗体阻断其作用,可以恢复CD8+T细胞的细胞毒性功能,有效抑制肿瘤生长。
研究意义在于揭示了FGF21作为一个“分泌型免疫检查点”,为癌症免疫治疗提供了新的靶点。通过抑制FGF21,可能为增强癌症免疫疗法的效果提供了一条新的策略路径,为癌症治疗提供了新的思路和方向。
数据图
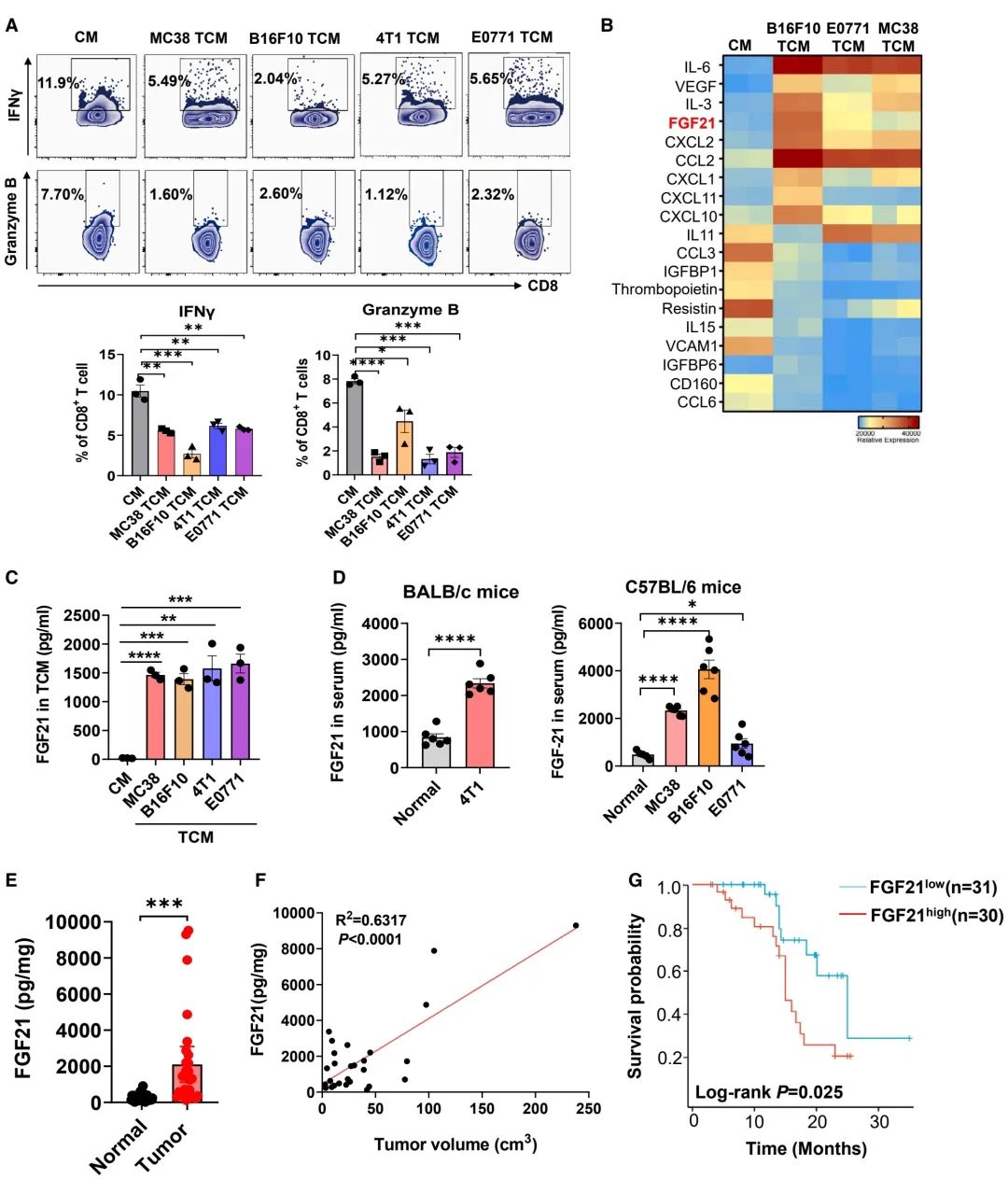
图 1:FGF21表达与肿瘤进展的不良预后相关
(A) 使用对照培养基(CM)或肿瘤条件培养基(TCM)处理的CD8+ T细胞,在经过抗CD3/CD28激活72小时后,通过流式细胞术(FACS)分析IFNg+和granzyme B+的表达情况(n = 3个生物重复)。
(B) 通过细胞因子芯片阵列分析上述指定肿瘤细胞系的CM和TCM中的细胞因子丰度的热图。
(C) 通过酶联免疫吸附测定(ELISA)分析上述指定肿瘤细胞系的CM和TCM中FGF21蛋白水平(n = 3个生物重复)。
(D) 通过ELISA分析正常小鼠与携带肿瘤的小鼠血清中的FGF21蛋白水平(n = 6只小鼠)。
(E) 通过ELISA分析结肠癌患者切除的肿瘤组织及相邻正常组织的组织裂解液中FGF21蛋白水平(n = 29名患者)。
(F) 分析结肠癌患者体内FGF21蛋白水平与肿瘤体积之间的相关性(n = 28名患者)。进行了线性回归分析。
(G) 通过Kaplan-Meier生存分析,比较被分类为FGF21高表达(n = 30名患者)和FGF21低表达(n = 31名患者)的结肠癌患者的生存情况,使用Log-rank检验。
数据表示为均值 ± 标准误差。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,通过学生t检验进行比较(A 和 C–E)。
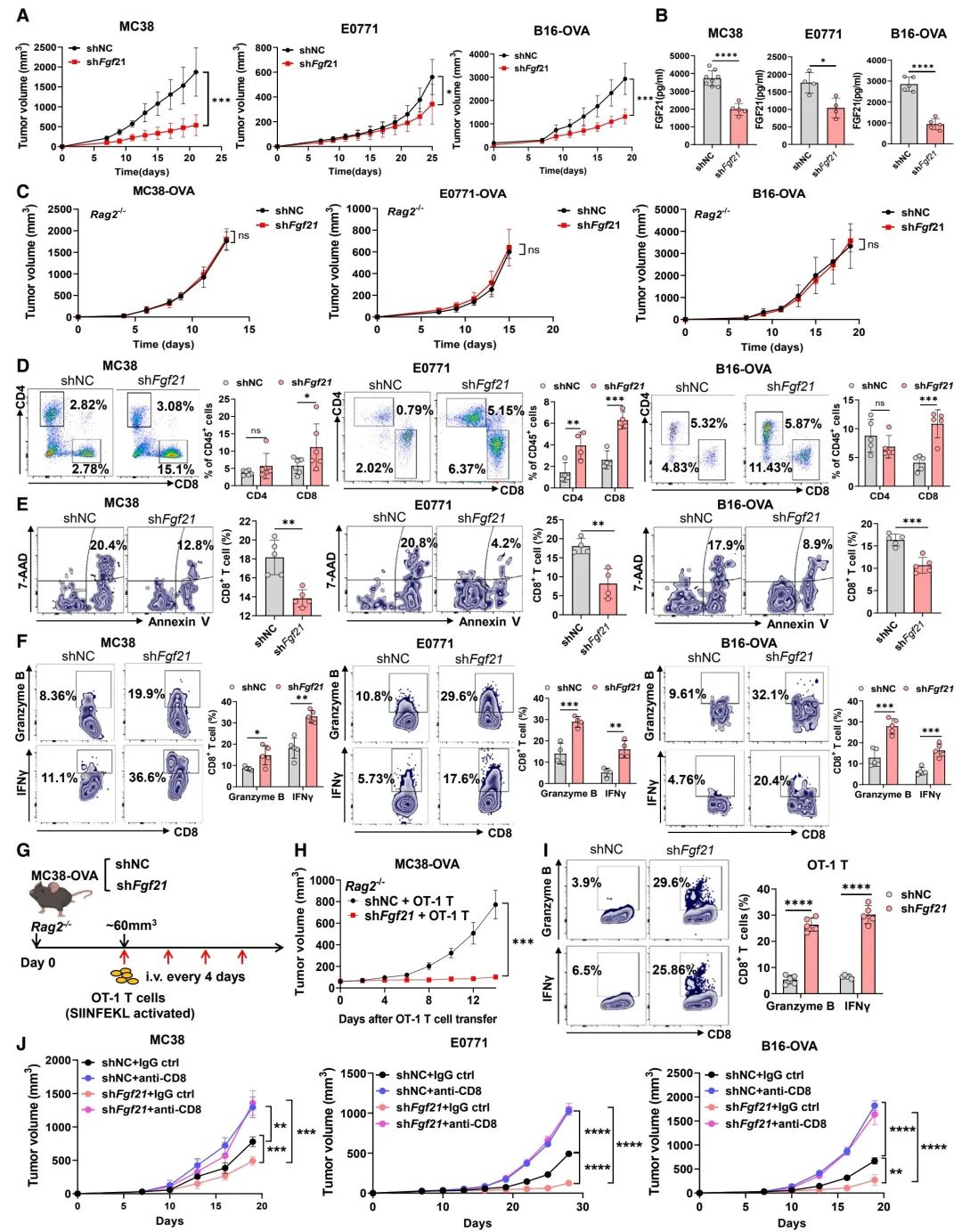
图 2:肿瘤细胞中FGF21的缺失通过增强肿瘤浸润T细胞来抑制肿瘤生长
(A) 在接种了对照(shNC)或shFgf21肿瘤细胞的野生型(WT)小鼠中,MC38、E0771和B16-OVA肿瘤的生长曲线(n = 5–8只小鼠)。
(B) 对(A)中携带肿瘤的小鼠血清进行的FGF21水平的ELISA分析(n = 5–8只小鼠)。
(C) 在接种了shNC或shFgf21肿瘤细胞的Rag2-/-小鼠中的肿瘤生长曲线(n = 5只小鼠)。
(D–F) 通过流式细胞术(FACS)分析shNC和shFgf21肿瘤中的肿瘤浸润T细胞比例(D)、CD8+ T细胞凋亡情况(E)以及CD8+ T细胞中granzyme B+和IFNg+的表达(F)(n = 4–6只小鼠)。
(G) 对OT-1 CTLs细胞过继性转移的示意图。
(H) 在接受OT-1 CTLs细胞过继性转移的shNC和shFgf21肿瘤携带的Rag2-/-小鼠中的肿瘤生长曲线(n = 5只小鼠)。
(I) 在进行OT-1 CTLs细胞过继性转移后,通过FACS分析CD8+ T细胞中granzyme B+和IFNg+的表达(n = 5只小鼠)。
(J) 在CD8+ T细胞耗竭后,shNC或shFgf21肿瘤的生长曲线(n = 5只小鼠)。
数据表示为均值 ± 标准误差。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,ns表示无统计学意义,通过学生t检验(B和E)以及双向方差分析(A, C, D, F, H, I, 和 J)。
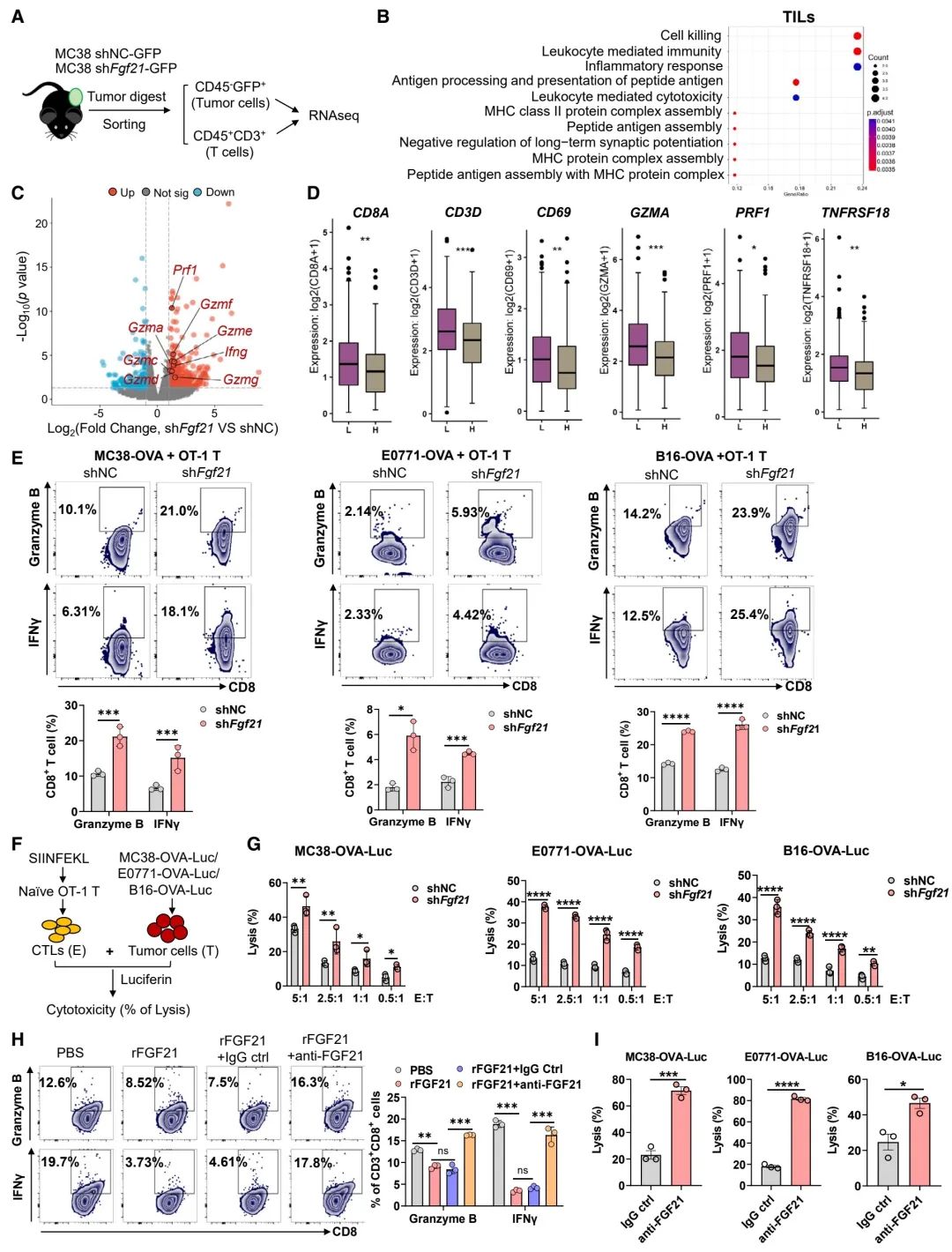
图 3:肿瘤分泌的FGF21限制CD8+ T细胞的细胞毒作用
(A) shNC和shFgf21肿瘤细胞形成的MC38肿瘤中分选出的肿瘤细胞和T细胞的RNA测序示意图。
(B) 如(A)所述,对肿瘤浸润淋巴细胞(TILs)进行的Go富集分析。
(C) 如(A)所述,TILs差异表达基因(DEGs)的火山图。
(D) 来自TCGA数据库,比较结直肠癌患者中FGF21高表达组与低表达组的CTL特征的箱线图。
(E) 经过12小时共培养后,OT-1 CD8+ T细胞对表达shNC或shFgf21的OVA肿瘤细胞的granzyme B+和IFNγ+的流式细胞分析(n = 3个生物重复)。
(F) 分析OT-1 CTLs细胞毒性的示意图。
(G) OT-1 CTLs孵育后,表达shNC或shFgf21的OVA肿瘤细胞的溶解百分比(n = 3个生物重复)。
(H) 经过rFGF21处理,或加上免疫球蛋白G(IgG)对照或抗FGF21处理的,经抗CD3/CD28激活的CD8+ T细胞的granzyme B+和IFNγ+的流式细胞分析(n = 3个生物重复)。
(I) 预处理了IgG对照或抗FGF21的,表达OVA的肿瘤细胞,随后与OT-1 CTLs共培养的细胞溶解百分比(n = 3个生物重复)。
数据表示为均值 ± 标准误差。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001, ns表示无显著性,通过学生t检验(D和I)和双向方差分析(E, G, 和 H)。
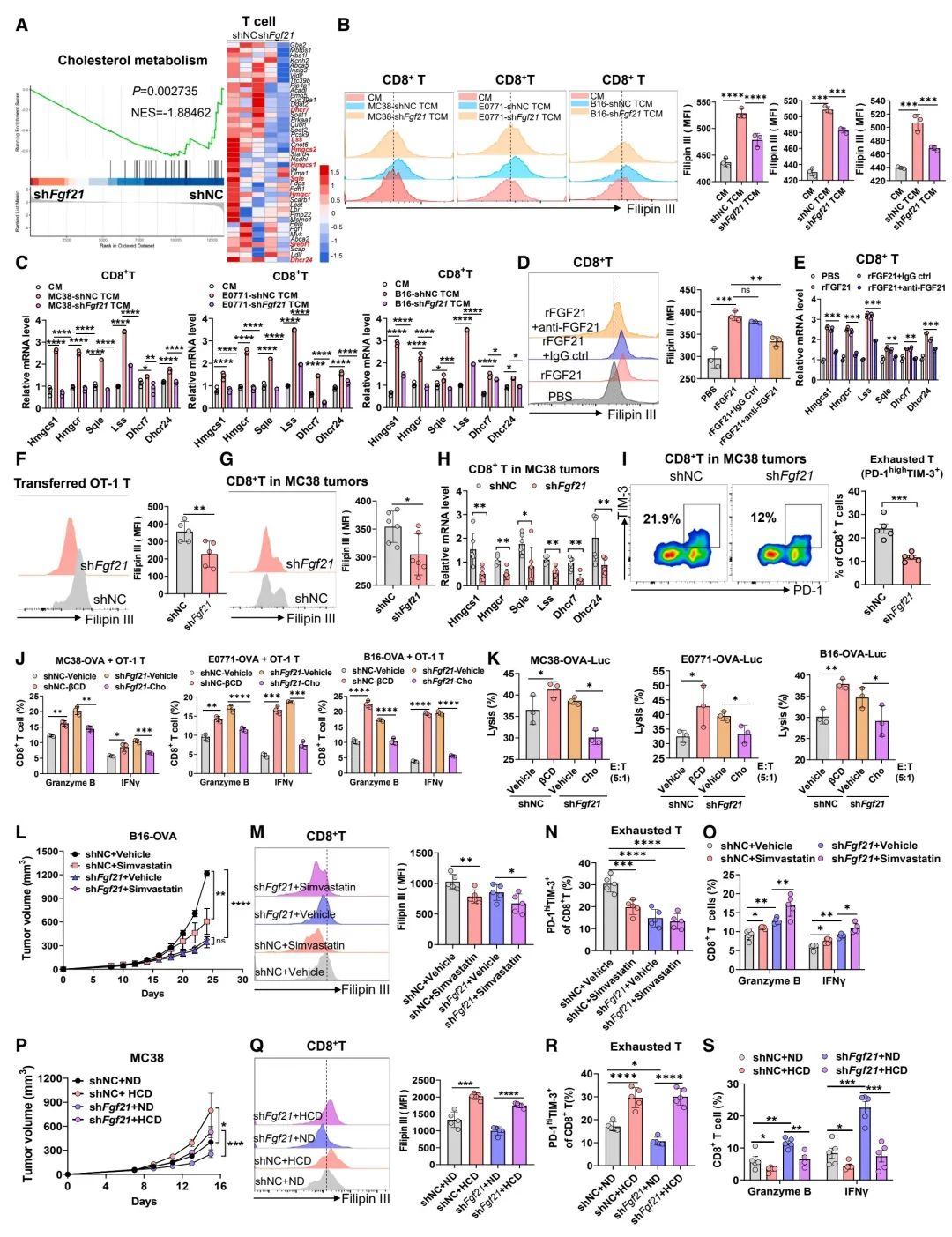
图 4:FGF21促进胆固醇产生,破坏CD8+ T细胞的抗肿瘤活性
(A) 利用基因集富集分析(GSEA)分析,研究来源于shNC和shFgf21 MC38肿瘤中肿瘤浸润T细胞的胆固醇代谢基因特征。
(B 和 C) Filipin III染色显示胆固醇含量(B)和抗CD3/CD28激活的CD8+ T细胞在对照培养基(CM)或肿瘤条件培养基(TCM)中培养72小时后,胆固醇相关基因的实时PCR分析(C)(n = 3个生物重复)。
(D 和 E) Filipin III染色显示胆固醇含量(D)和抗CD3/CD28激活的CD8+ T细胞在经rFGF21处理,或加上IgG对照或抗FGF21处理72小时后,胆固醇相关基因的实时PCR分析(E)(n = 3个生物重复)。
(F) 从shNC或shFgf21 MC38-OVA肿瘤携带的Rag2-/-小鼠中转移的OT-1 T细胞的Filipin III染色显示的胆固醇含量(n = 5只小鼠)。
(G 和 H) Filipin III染色显示的胆固醇含量(G)和来自shNC或shFgf21 MC38肿瘤的CD8+ T细胞的胆固醇相关基因的实时PCR分析(H)(n = 6只小鼠)。
(I) shNC或shFgf21 MC38肿瘤中终末耗竭T细胞的流式细胞分析(n = 5只小鼠)。
(J) 在添加了β-环糊精或胆固醇的条件下,OT-1 CD8+ T细胞与表达shNC或shFgf21的OVA肿瘤细胞共培养后,granzyme B+和IFNγ+的百分比(n = 3个生物重复)。
(K) 添加了β-环糊精或胆固醇后,OT-1 CTLs孵育的shNC或shFgf21肿瘤细胞的溶解百分比(n = 3个生物重复)。
(L) 经过溶剂对照处理或辛伐他汀处理的shNC或shFgf21 B16-OVA肿瘤的生长曲线(n = 5–6只小鼠)。
(M–O) 在(L)中,CD8+ T细胞的Filipin III胆固醇染色(M),终末耗竭T细胞(N)和granzyme B+及IFNγ+ CD8+ T细胞的百分比(O)的流式细胞分析(n = 5只小鼠)。
(P) 在常规饮食(ND)和高胆固醇饮食(HCD)喂养的小鼠中,shNC或shFgf21 MC38肿瘤的生长曲线(n = 5–6只小鼠)。
(Q–S) 在(P)中,CD8+ T细胞的Filipin III胆固醇染色(Q),终末耗竭T细胞(R)和granzyme B+及IFNγ+ CD8+ T细胞的百分比(S)的流式细胞分析(n = 5只小鼠(n = 5只小鼠)。
数据以均值 ± 标准误差呈现。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,ns表示无显著性差异,通过学生t检验(B, D, F, G, I, K, M, N, Q, 和 R)和双向方差分析(C, E, H, J, L, O, P, 和 S)。
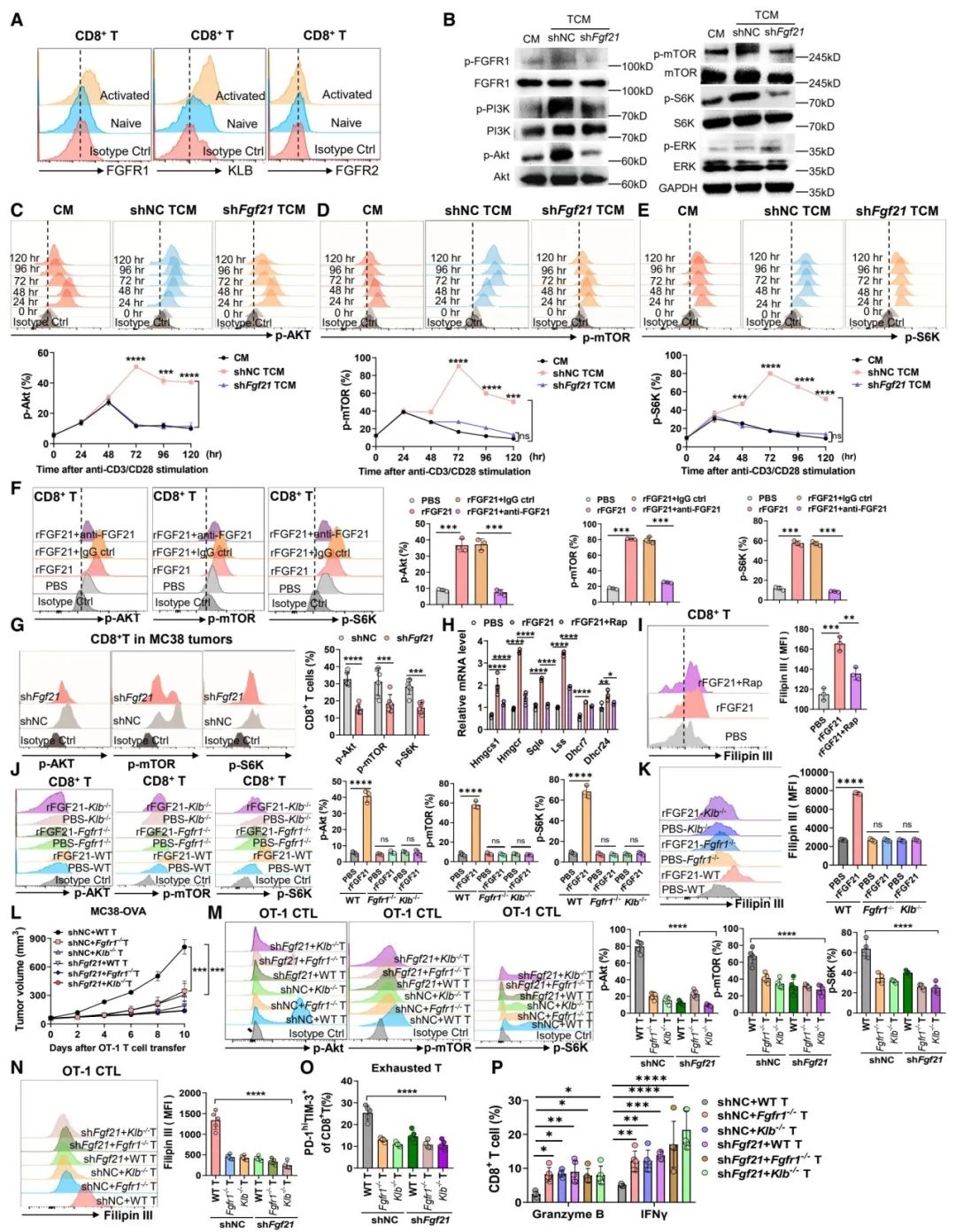
图 5:FGF21通过FGFR1-KLB受体维持AKT-mTORC1信号的过度激活,从而在CD8+ T细胞中加剧胆固醇生物合成
(A) 使用抗CD3/CD28刺激72小时后,对初始或激活的CD8+ T细胞中FGFR1、KLB和FGFR2表达的流式细胞分析。
(B) 抗CD3/CD28激活的CD8+ T细胞中p-FGFR1/FGFR1、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、p-S6K/S6K和p-ERK/ERK的免疫印迹分析(n = 3个独立实验)。
(C–E) 在抗CD3/CD28刺激后的指定时间点,使用对照培养基(CM)或来自shNC或shFgf21 MC38肿瘤细胞的肿瘤条件培养基(TCM)培养的CD8+ T细胞中p-AKT、p-mTOR和p-S6K的流式细胞分析(n = 3个生物重复)。
(F) 在抗CD3/CD28刺激72小时后,rFGF21以及IgG对照或抗FGF21处理的CD8+ T细胞中p-AKT、p-mTOR和p-S6K的流式细胞分析(n = 3个生物重复)。
(G) 来自shNC或shFgf21 MC38肿瘤的CD8+ T细胞中p-AKT、p-mTOR和p-S6K的流式细胞分析(n = 5只小鼠)。
(H 和 I) 在rFGF21处理,或加上雷帕霉素处理72小时后,抗CD3/CD28激活的CD8+ T细胞中胆固醇相关基因的实时PCR分析(H)和Filipin III胆固醇染色(I)(n = 3个生物重复)。
(J 和 K) 在抗CD3/CD28刺激72小时后,使用PBS或rFGF21处理的WT、Fgfr1-/-和Klb-/- CD8+ T细胞中p-AKT、p-mTOR和p-S6K (J)和Filipin III胆固醇染色(K)的流式细胞分析(n = 3个生物重复)。
(L) 在WT、Fgfr1-/-和Klb-/- OT-1 CTLs细胞过继性转移后,携带shNC或shFgf21 MC38-OVA肿瘤的Rag2-/-小鼠的肿瘤生长曲线(n = 5只小鼠)。
(M–P) 在(L)中,p-AKT、p-mTOR、p-S6K (M),Filipin III胆固醇染色(N),末端耗竭T细胞的百分比(O)和OT-1 CTLs中granzyme B+和IFNγ+的百分比(P)的流式细胞分析(n = 5只小鼠)。
数据以均值 ± 标准误差表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,ns表示无显著性差异,通过学生t检验(F, I, J, K, 和 M–O)和双向方差分析(C–E, G, H, L, 和 P)。
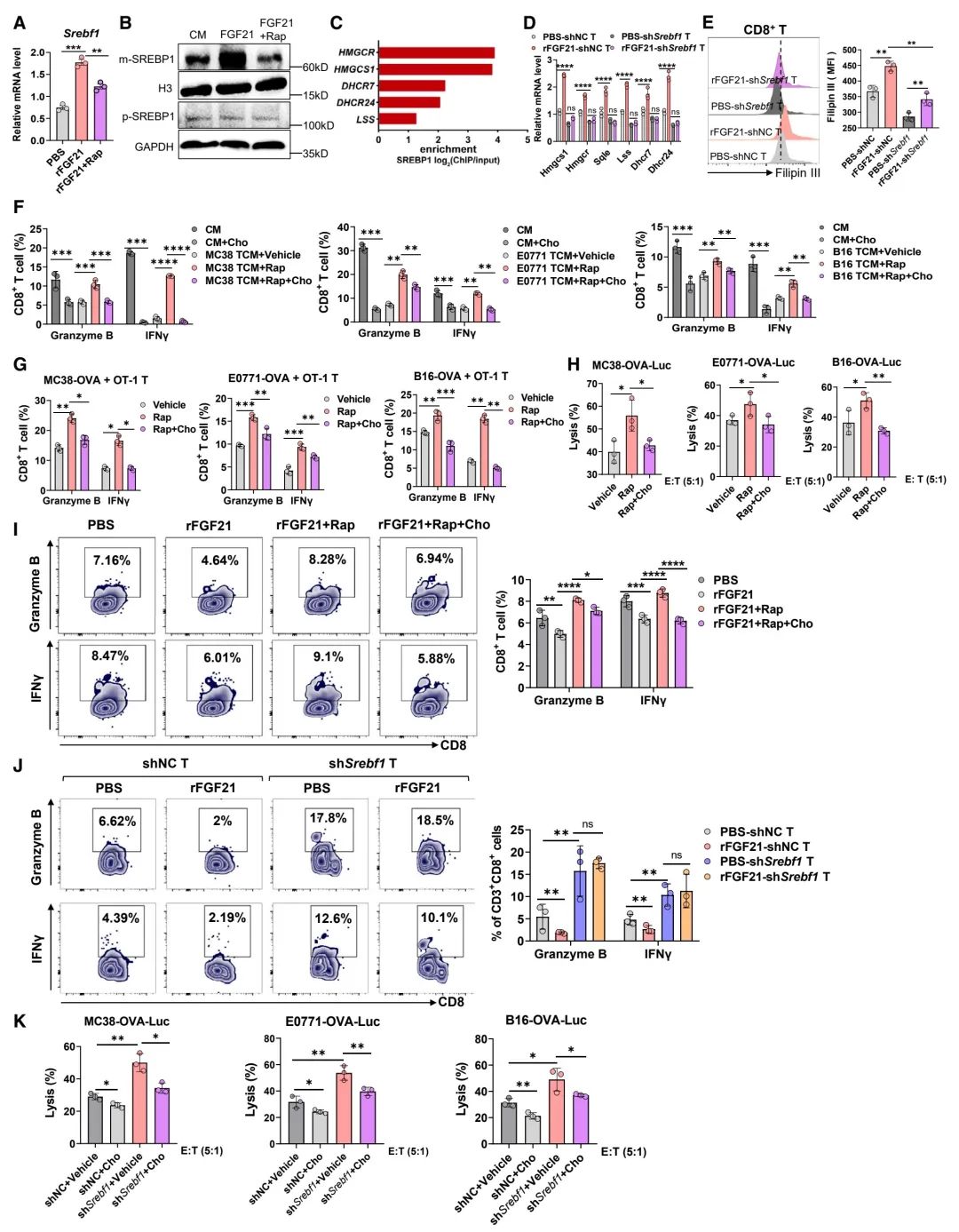
图 6:抑制FGF21激活的mTORC1-SREBP1恢复CD8+ T细胞功能
(A) 在rFGF21处理,或加上雷帕霉素处理72小时后,抗CD3/CD28激活的CD8+ T细胞中Srebf1表达的实时PCR分析(n = 3个生物重复)。
(B) 在rFGF21处理,或加上雷帕霉素处理72小时后,抗CD3/CD28激活的CD8+ T细胞中细胞核的成熟SREBP1(m-SREBP1)和细胞质的前体SREBP1(p-SREBP1)的免疫印迹分析(n = 3个独立实验)。
(C) SREBP1的启动子结合分析。
(D 和 E) 在PBS或rFGF21处理下,抗CD3/CD28激活的shNC或shSrebf1 CD8+ T细胞中胆固醇相关基因(D)的实时PCR分析和胆固醇的Filipin III染色(E)(n = 3个生物重复)。
(F) 经CM、TCM或加上雷帕霉素、胆固醇处理72小时后,抗CD3/CD28激活的CD8+ T细胞中granzyme B+和IFNγ+细胞的百分比(n = 3个生物重复)。
(G) 经rapamycin或胆固醇添加后,与表达OVA的肿瘤细胞共培养12小时的OT-1 T细胞中granzyme B+和IFNγ+的百分比(n = 3个生物重复)。
(H) 经rapamycin或胆固醇预处理24小时后,与OT-1 CTLs共培养的表达OVA的肿瘤细胞的溶解百分比(n = 3个生物重复)。
(I) 在rFGF21处理,或加上雷帕霉素、胆固醇处理72小时后,抗CD3/CD28激活的CD8+ T细胞中granzyme B+和IFNγ+的流式细胞分析(n = 3个生物重复)。
(J) 在PBS或rFGF21处理下,抗CD3/CD28激活的shNC或shSrebf1 CD8+ T细胞中granzyme B+和IFNγ+的流式细胞分析(n = 3个生物重复)。
(K) 经对照或胆固醇预处理24小时后,与shNC或shSrebf1 OT-1 CTLs共培养的表达OVA的肿瘤细胞的溶解百分比(n = 3个生物重复)。
数据以均值 ± 标准误差表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,ns表示无显著性差异,通过学生t检验(A, E, H, 和 K)和双向方差分析(D, F, G, I, 和 J)。
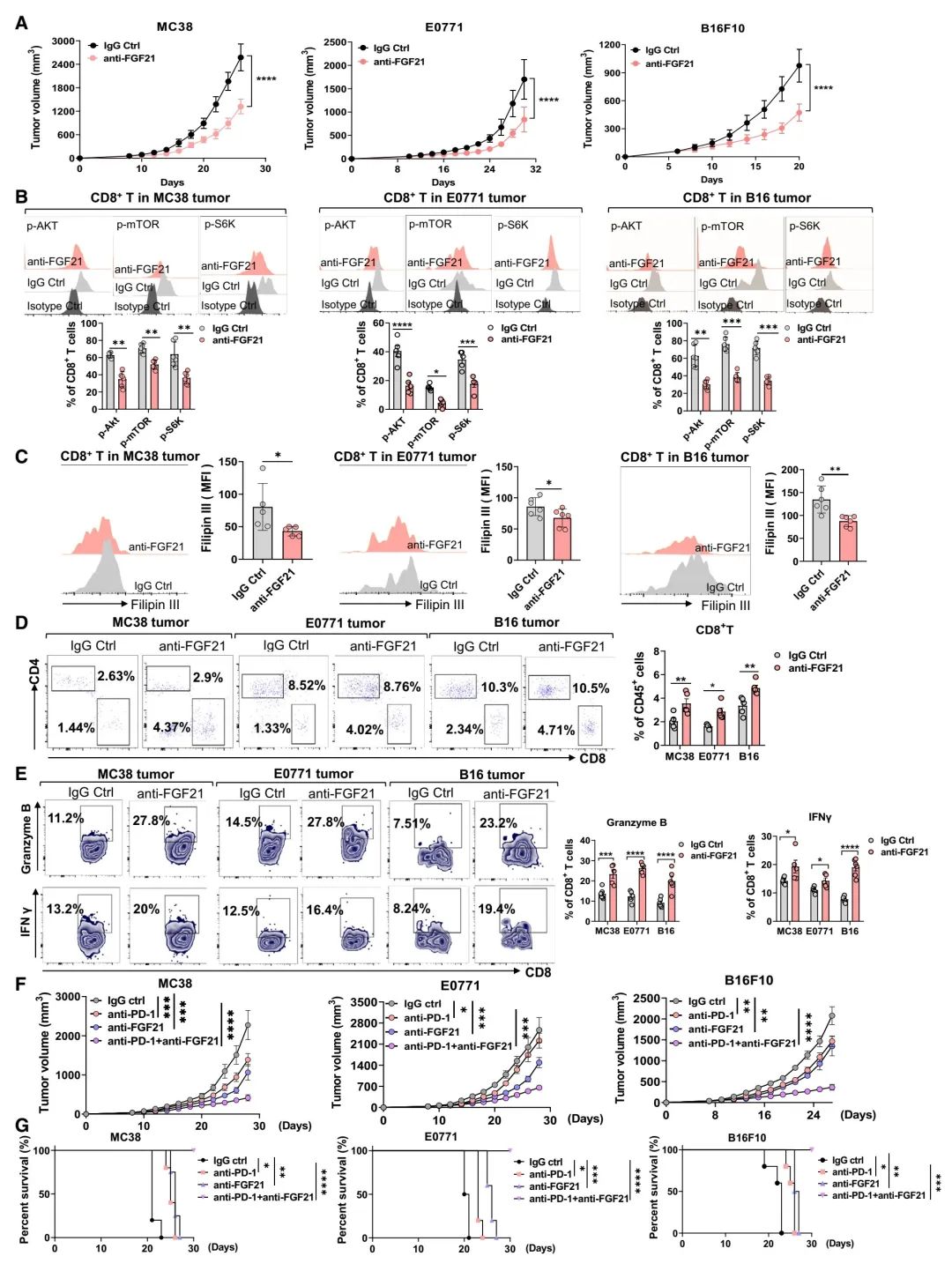
图 7:中和FGF21可抑制肿瘤生长,并与抗PD-1阻断发挥协同作用
(A) 在静脉注射了IgG对照或抗FGF21的WT小鼠中,MC38、E0771和B16F10肿瘤的生长曲线(n = 6只小鼠)。
(B 和 C) 如(A)所述,CD8+ T细胞中p-AKT、p-mTOR和p-S6K (B)及Filipin III胆固醇染色(C)的流式细胞分析(n = 5–6只小鼠)。
(D 和 E) 如(A)所述,CD8+ T细胞中CD8+T细胞百分比(D)和granzyme B+及IFNg+ CD8+T细胞(E)的流式细胞分析(n = 5只小鼠)。
(F) 经IgG对照、抗PD-1、抗FGF21或抗PD-1联合抗FGF21处理的MC38、E0771和B16F10肿瘤携带小鼠的肿瘤生长曲线(n = 5只小鼠)。
(G) 如(F)所述,小鼠存活的Kaplan-Meier分析(n = 5只小鼠)。
数据以均值 ± 标准误差表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,通过学生t检验(C),双向方差分析(A, B, D, E, 和 F),以及log-rank检验(G)。
OncoLab公众号已增加期刊查询功能,SCI期刊可查询期刊名称缩写、ISSN刊号、近五年影响因子、最新WOS的JCR分区、最新中科院分区以及中科院期刊预警信息;
中文期刊可检索CSCD核心、北大中文核心、科技核心收录情况;
在公众号对话框发送杂志名称即可快速检索,支持模糊检索,欢迎使用!

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏