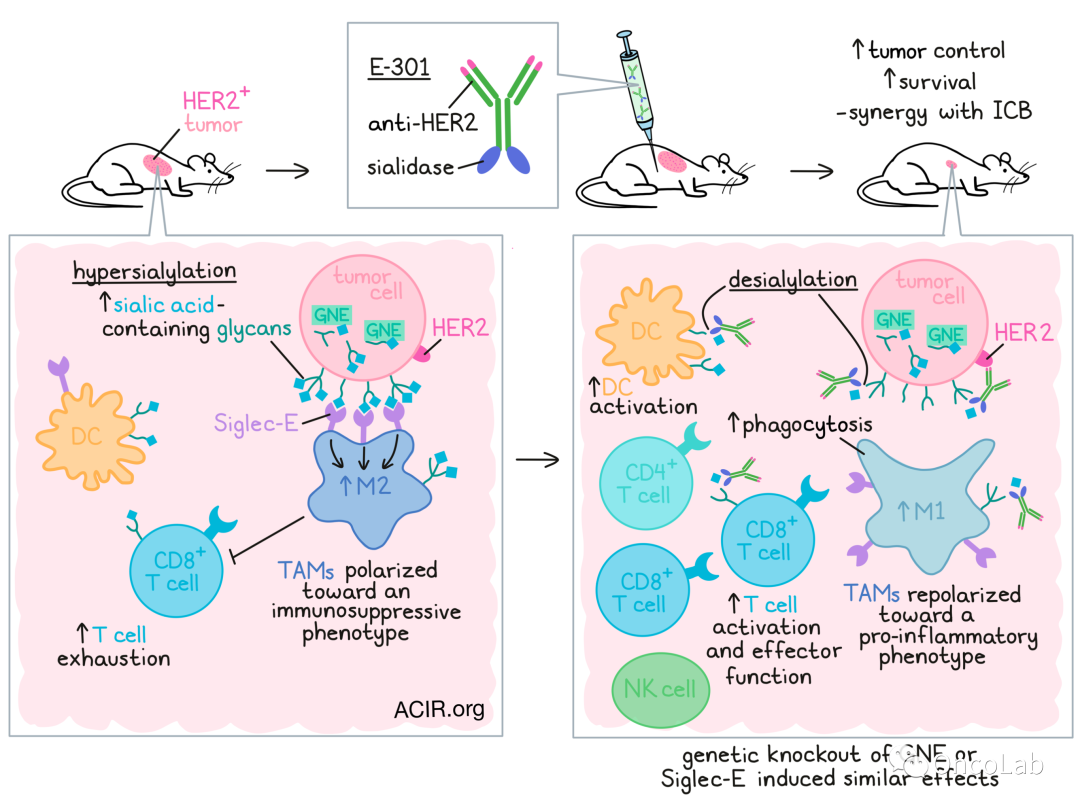
在癌症中,含唾液酸的聚糖上调(高唾液酸化)是一个已被证明可通过与Siglec受体结合和抑制肿瘤免疫细胞浸润来驱…
在癌症中,含唾液酸的聚糖上调(高唾液酸化)是一个已被证明可通过与Siglec受体结合和抑制肿瘤免疫细胞浸润来驱动疾病进展和免疫逃逸的特征。在之前的工作中,Stanczak等人证明,基因去唾液酸化或唾液酸酶治疗可减缓肿瘤生长,并有助于抗肿瘤免疫。在最近发表于《科学转化医学》(Science Translational Medicine)的研究中,Stanczak等人进一步挖掘了这一机制的细节,并探索了利用它进行癌症免疫治疗的策略。
首先,Stanczak等利用癌症基因组图谱(The Cancer Genome Atlas, TCGA)的数据确定了唾液酸聚糖的基因特征与几种癌症类型(最显著的是肾透明细胞癌[KIRC]和鳞状细胞肺癌[LUSC])的免疫功能调节、细胞因子活性降低和患者生存期缩短呈正相关。该基因集还与免疫抑制和促肿瘤免疫细胞(包括Tregs和TAMs)的存在、CD4+ T细胞减少和CD8+ T细胞功能障碍强相关。这些结果在患者样本中得到了验证,其中Siglec-9 Fc结合(表面唾液酸化聚糖的指标)与较差的生存期相关(在KIRC中),而唾液酸酶治疗增加了T细胞的活化(在LUSC中)。
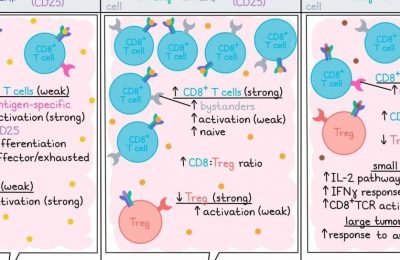
在小鼠模型中,研究人员使用了GNE基因敲除(唾液酸生物合成的限速酶)的MC38肿瘤。之前的工作显示,与野生型MC38相比,GNE-KO MC38肿瘤的生长延迟,小鼠生存期增加,这一效应依赖于CD8+ T细胞,并且可以通过抗PD-1和抗CTLA-4(ICB)增强。在第7天分离出TILs的重复实验中,ICB单独处理增加了WT和GNE-KO肿瘤中IFNγ+和IFNγ+TNFα+ CD8+ T细胞的频率,但仅诱导了GNE-KO肿瘤中IFNγ+TNFα+IL-2+ CD8+ T细胞的频率,表明去脱氢修饰可以在ICB治疗的背景下增强T细胞的活化。在其他肿瘤细胞系和小鼠品系中也观察到了类似的结果。
接下来,研究人员使用抗体唾液酸酶融合产物E-301评估了治疗性去唾液酸化的效果,E-301包含HER2靶向抗体(曲妥珠单抗)和与抗体c末端Fc区融合的两个唾液酸酶结构域。体外实验中,E-301可诱导EMT6-HER2乳腺癌细胞发生剂量依赖性的去唾液酸化。同样,在携带已建立的EMT6-HER2肿瘤的小鼠中,单次腹腔内给药诱导的脱唾液酸作用在24小时时最明显,在72小时时仍然明显。在同一时间点,肿瘤也显示出Siglec配体的丢失,进一步验证了结果。
为了更仔细地观察去唾液酸化对免疫细胞的影响,研究人员将野生型和GNE-KO的EMT6-HER2肿瘤植入小鼠的相对侧体内。基因敲除组唾液酸化水平降低,E-301组唾液酸化水平进一步降低。E-301处理后,两侧浸润的免疫细胞均发生去唾液酸化。我们在多种免疫细胞(包括TAMs、DCs、PMN-MDSCs、Tregs和CD8+ T细胞)中观察到这一效应,但未观察到M-MDSCs、传统CD4+ T细胞或NK细胞的变化。
Stanczak等还发现,在携带B16D5-HER2黑色素瘤肿瘤的小鼠中,E-301治疗诱导了许多免疫浸润的变化,治疗增加了CD45+和CD8+ T细胞的绝对数量、DC活化、抗肿瘤NK细胞亚群、效应性CD8+ T细胞以及Th1和Th2 CD4+ T细胞,同时减少了初始CD4+ T细胞和耗竭的CD8+ T细胞。巨噬细胞发生了尤其显著的变化,表明其从免疫抑制程度更高的表型转变为促炎程度更高的表型,其迁移、对趋化因子的反应以及产生效应分子和促炎细胞因子的迹象增多。研究人员还注意到M1型巨噬细胞的增加和M2型巨噬细胞的减少,从而改变了M1:M2比率。在E-301处理的EMT6-HER2肿瘤模型和ICB处理的GNE-KO肿瘤模型中也观察到类似的免疫变化。
研究人员更仔细地观察了TAMs的变化,将肿瘤来源的TAMs与初始CD8+ T细胞共培养,发现T细胞与来自去唾液酸化肿瘤的TAMs共培养时,增殖和活化程度更高。此外,当去唾液酸化的肿瘤细胞与骨髓来源的巨噬细胞(BMDMs)共培养时,BMDMs表达更高水平的TNFα和更强的吞噬活性。这些结果与唾液酸作为“不要吃我”信号的作用一致,并提示肿瘤细胞上的高水平唾液酸促进TAMs向免疫抑制、促肿瘤发生表型的极化。
为了研究去唾液酸化如何使巨噬细胞复极化,Stanczak等人的结果表明,在常见的抑制性CD33相关Siglecs中,Siglec-E在TAMs上表达最广泛,并且在抗肿瘤TAMs上表达最高,而在E-301治疗的肿瘤中表达增加。在Siglec-E-KO小鼠中,GNE-KO肿瘤生长和野生型一样,E-301治疗各种肿瘤无效。在通过抗CSF1R抗体治疗去除TAMs的小鼠中,以及在CD11c+细胞上有条件敲除Siglec-E的小鼠中观察到类似结果,CD11c+细胞的群体包括TAMs、DCs和PMN-MDSCs,但主要代表TAMs (DCs上的Siglec-E对效应的贡献很小)。在Siglec-E条件性敲除模型中,TAMs显示出减少的M2极化。在体外,Siglec-E-KO TAMs在E-301处理后没有复极或增加共培养T细胞的活化。
在评估E-301作为免疫疗法的潜在疗效时,研究人员表明,在携带EMT6-HER2原位肿瘤的小鼠中,4剂E-301延迟了肿瘤生长并提高了生存率,12只小鼠中有1只完全排斥肿瘤。当对侧的EMT6和EMT6-HER2肿瘤再次攻击这只小鼠时,这两种肿瘤均被排斥,这表明有超过HER2的较强的免疫记忆和诱导的反应。在B16D5-HER2模型中也观察到了类似的结果,其中E-301治疗降低了肿瘤对CD8+ T细胞的依赖性生长,并与ICB有协同作用。抗PD-1和ICB在Siglec-E-KO小鼠中也更有效,18只Siglec-E-KO小鼠中有14只(78%)排斥肿瘤,而15只野生型小鼠中有4只(27%)排斥肿瘤。
总之,这些结果表明,肿瘤细胞的高唾液酸化通过与Siglec-E的相互作用促进TAMs向免疫抑制表型极化。它们也支持唾液酸聚糖-Siglec轴作为免疫治疗的靶点,因为治疗性去唾液酸化可以促进TAMs的复极化,并支持强大的抗肿瘤免疫应答,特别是在ICB的情况下。
本周,第一作者Michal A. Stanczak和第一作者Heinz Läubli回答了我们的问题。
左边是Michal A. Stanczak,右边是Heinz Läubli
对你来说,这项研究最令人惊讶的发现是什么?
HL:这项研究最令人惊讶的发现是多个实验模型中结果的稳健性。无论是通过遗传方法还是酶促方法,去除唾液酸都提高了抗肿瘤免疫。
MAS:对我来说,这种机制的简单性是最令人惊讶的。长期以来,我们一直在思考和推测糖基的不可思议的异质性以及Siglec受体功能冗余的可能性。虽然我们不能排除其中一些起作用,Siglec-E在TAMs上的特异性表达被证明是单一的主导机制,赋予我们的肿瘤唾液化的免疫抑制效果。
前景如何?
HL和MAS:一系列基础和临床前研究支持将肿瘤糖基化作为癌症免疫治疗的潜在靶点。该领域的下一步将是对这种潜力的临床测试。将人唾液酸酶递送给癌症患者的早期临床研究目前正在进行中(GLIMMER-01研究)。虽然这是否最终会成为最好的方法还有待观察,但未来的研究将进一步针对治疗干预后髓系细胞的确切细胞内事件,并将比较阻断唾液酸- Siglec相互作用的不同方法的疗效,无论是通过阻断Siglec受体还是直接靶向唾液酸。
工作之外,你最近学到的最酷的事情是什么?
HL:我最近学到的最酷的事情是,我9岁的儿子已经比我冰球打得好了….
MAS: 我最近开始从零开始自己做意大利面。做了一点实验,和实验室里的工作没什么不同,但结果更美味。
来源 | ACIR.ORG & Sci Transl Med.
▉ 强烈推荐
本公众号上的往期文章同步发布至对应网站OncoLab实验室。
网站自带检索功能,可以根据关键词进行检索,并且可以根据日期及内容分类进行查看 ,大家可以收藏方便在电脑上查看。
网址是:oncolab.cn
▉ OncoLab学术导航
此外,梳理了一下这几年攒的收藏夹,做了一个导航网页,包含常用网站、文献阅读、试剂订购、基金相关、实用工具、常用数据库等分类内容,并且整合了百度、谷歌、必应三大搜索引擎到检索工具中,欢迎收藏或设置为主页使用~
网址是:dh.oncolab.cn
▉ OncoLab知识星球
OncoLab知识星球也已开通,在学习本公众号内容的过程中如果有什么需要讨论交流的地方可以在星球发表留言,也可以分享一下自己的学习心得体会,其他小伙伴看到了可以积极留言回复,我也会积极参与其中,并时常放一些学习资料在上面,希望大家能够在积极交流互帮互助中共同进步~
该星球用于OncoLab公众号读者交流学习使用,永久免费。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
本篇文章来源于微信公众号: OncoLab




 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏