01
Nature. 20230405
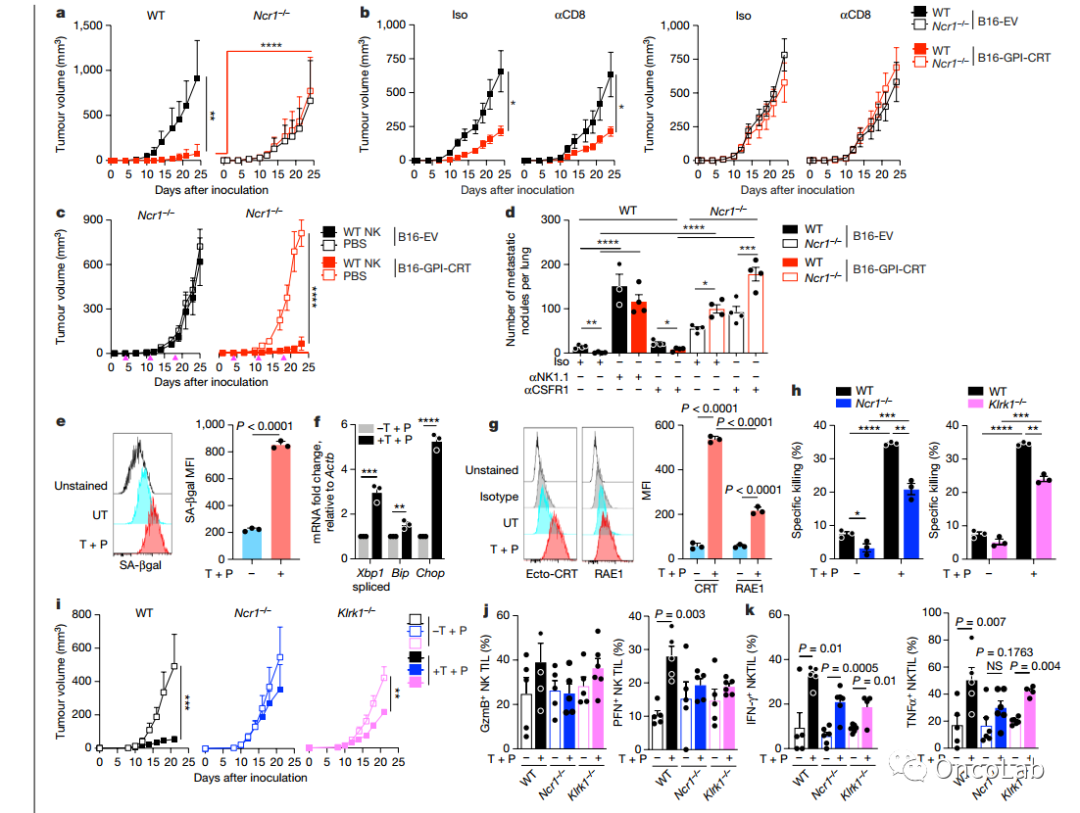
The NK cell receptor NKp46 recognizes ecto-calreticulin on ER-stressed cells
NK细胞受体NKp46可识别内质网应激细胞上的外源性钙网蛋白
Nature. 2023 Apr 5.
doi: 10.1038/s41586-023-05912-0.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37020026/
Abstract
自然杀伤(NK)细胞在激活型NK细胞受体被触发时杀死感染、转化和应激的细胞。大多数NK细胞和一些先天性淋巴细胞表达由NCR1编码的激活受体NKp46,这是最古老的NK细胞受体。阻断NKp46抑制了许多癌症靶细胞的NK细胞杀伤作用。尽管已经鉴定出一些感染性NKp46配体,但内源性NKp46细胞表面配体尚未知。在这里,我们展示NKp46识别内质网(ER)在应激过程中从内质网转移到细胞膜上的外源性钙网蛋白(ecto-CRT)。内质网应激和ecto-CRT是化疗诱导的免疫细胞死亡、黄病毒感染和衰老的特征。NKp46识别ecto-CRT的P结构域触发NK细胞信号传导,并在NK免疫突触中与ecto-CRT一起发生聚集。通过敲除或敲低编码CRT的CALR基因或CRT抗体抑制NKp46介导的杀伤作用,而通过表达糖基磷脂酰肌醇锚定的CRT增强该作用。缺乏NCR1的人类(和缺乏Nrc1的小鼠)NK细胞在杀死ZIKV感染的、内质网应激的、衰老细胞和表达ecto-CRT的癌细胞方面受损。重要的是,NKp46对ecto-CRT的识别控制了小鼠B16黑色素瘤和RAS驱动的肺癌,并增强了肿瘤浸润NK细胞的颗粒酶释放和细胞因子分泌。因此,NKp46识别ecto-CRT作为危险相关分子模式消除内质网应激细胞。
02
Gut. 20230405
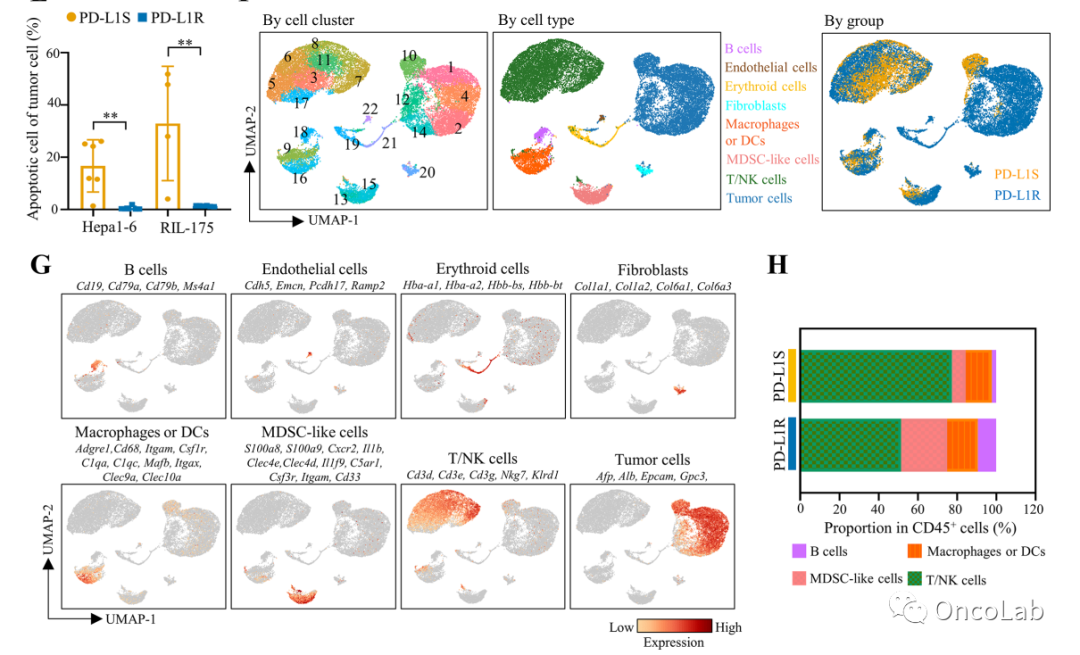
Targeting PPAR-gamma counteracts tumour adaptation to immune-checkpoint blockade in hepatocellular carcinoma
靶向PPAR-γ可消除肝细胞癌对免疫检查点阻断治疗的耐受
Gut. 2023 Apr 5;gutjnl-2022-328364.
doi: 10.1136/gutjnl-2022-328364.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37019619/
Abstract
目的:治疗诱导的肿瘤微环境(TME)重塑对癌症治愈构成重大障碍。由于大多数肝细胞癌(HCC)患者对抗程序性细胞死亡(配体)-1(抗-PD-[L]1)疗法表现出原发性或获得性抵抗,我们旨在研究肿瘤适应免疫检查点靶向治疗的机制。
设计:通过在抗PD-L1处理的同系基因型免疫功能正常小鼠中进行连续正交种植HCC细胞,生成两种免疫治疗耐药HCC模型,并通过单细胞RNA测序(scRNA-seq)、基因组和免疫分析进行研究。通过慢病毒介导的敲低和药理学抑制研究关键信号通路,并通过对来自pembrolizumab II期试验(NCT03419481)的HCC肿瘤活检样本进行scRNA-seq分析进行进一步验证。
结果:抗PD-L1耐药肿瘤在免疫功能正常小鼠中比亲本肿瘤生长大>10倍,而在免疫功能受损的小鼠中没有明显的基因变化,这伴随着肿瘤内髓源性抑制性细胞(MDSC)的积累、细胞毒性CD8+ T细胞的耗竭和排斥。在机制上,肿瘤细胞内源性过氧化物酶体增殖激活受体-γ(PPARγ)转录激活血管内皮生长因子-A(VEGF-A)的产生,以驱动MDSC扩张和CD8+ T细胞功能障碍。选择性PPARγ拮抗剂引发免疫抑制至免疫刺激TME转换,并使正交和自发HCC模型对抗PD-L1治疗重新敏感。重要的是,40%(6/15)对pembrolizumab耐药的HCC患者表现出肿瘤性PPARγ诱导。此外,多种癌症类型中抗PD-(L)1治疗患者的基线PPARγ表达较高与较差的生存率相关。
结论:我们发现了一种肿瘤细胞通过PPARγ/VEGF-A介导的TME免疫抑制逃避免疫检查点靶向治疗的适应性转录程序,从而为抗肝细胞癌免疫治疗耐药性提供了一个策略。
Keywords:
癌症免疫生物学;肝细胞癌;免疫治疗;PPAR GAMMA。
03
Cancer Cell. 20230410
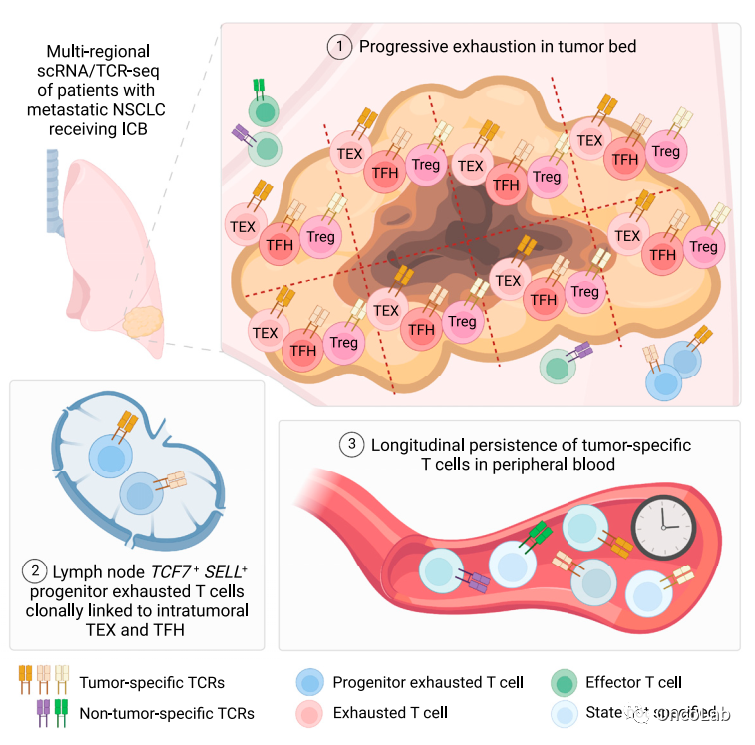
Lineage tracing reveals clonal progenitors and long-term persistence of tumor-specific T cells during immune checkpoint blockade
谱系追踪揭示在免疫检查点阻断期间的克隆祖细胞和长期持续存在的肿瘤特异性T细胞
Cancer Cell. 2023 Apr 10;41(4):776-790.e7.
doi: 10.1016/j.ccell.2023.03.009.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37001526/
Abstract
配对的单细胞RNA和T细胞受体测序(scRNA/TCR-seq)已经使得在癌症中T细胞克隆的动态解析度得到提高。在这里,我们报告了对187,650个T细胞的scRNA/TCR-seq分析,这些T细胞来自31个组织区域,包括在免疫检查点阻断(ICB)治疗后的非小细胞肺癌患者的肿瘤、邻近正常组织和淋巴结(LN)。含有活的癌细胞的区域富集了耗竭的CD8+ T细胞、调节性CD4+ T细胞(Treg)和滤泡辅助性CD4+ T细胞(TFH)。通过在组织之间追踪T细胞克隆型,结合新抗原特异性测定,揭示了TFH和肿瘤特异性耗竭的CD8+ T细胞在肿瘤引流的LN中与TCF7+SELL+祖细胞克隆相关,并且在靠近肿瘤微环境时,CD8+ T细胞、Treg和TFH细胞的耗竭程度逐渐加重。最后,对肿瘤特异性CD8+和CD4+ T细胞克隆的纵向追踪显示,在ICB治疗后数年,它们在外周血中持续存在。
Keywords:
TCF-1祖细胞耗竭型T细胞;耗竭型T细胞;免疫检查点阻断;肺癌;单细胞RNA/TCR测序;肿瘤特异性T细胞。
04
Trends Cancer. 20230420
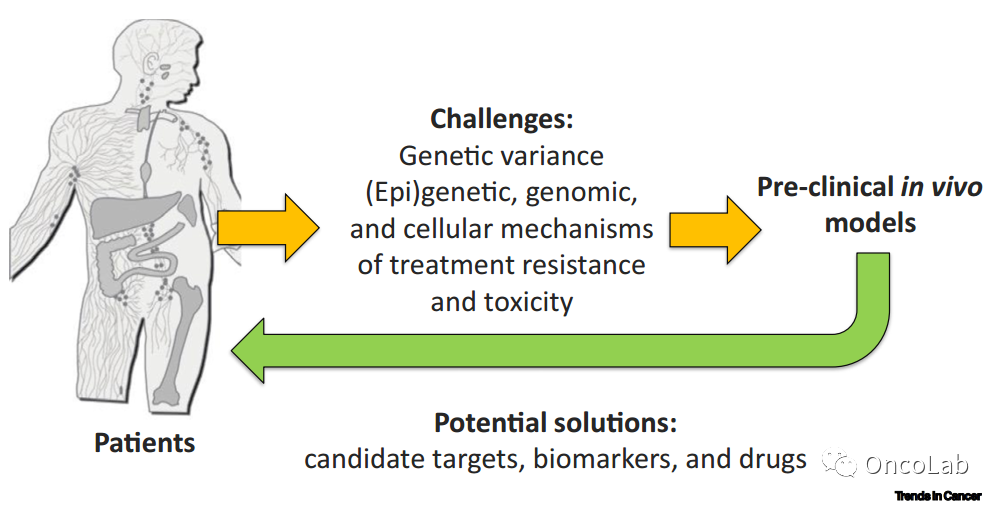
Mouse models for immuno-oncology
免疫肿瘤学的小鼠模型
Trends Cancer. 2023 Apr 20;S2405-8033(23)00041-9.
doi: 10.1016/j.trecan.2023.03.009.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37087398/
Abstract
实现癌症免疫疗法的临床前景受到我们对体内机制的了解不足以及治疗限制性毒性的影响。需要临床前体内模型系统和技术来填补这些空缺,以克服免疫疗法在临床应用中面临的挑战。小鼠通常用于基础和转化研究,以支持免疫干预手段的开发和测试,包括癌症。在这里,我们讨论了现有模型的优点和局限性以及未来的发展。
Keywords:
癌症免疫治疗;协同交叉小鼠;多样性杂交小鼠;基因工程小鼠;人源化小鼠;小鼠模型。
05
Cell. 20230330-1
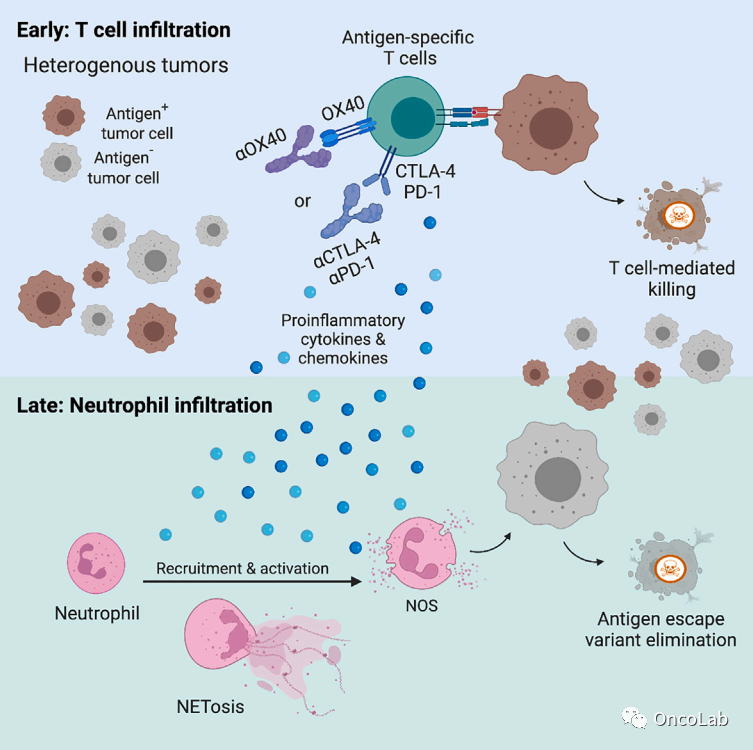
T cell immunotherapies engage neutrophils to eliminate tumor antigen escape variants
T细胞免疫疗法通过激活中性粒细胞消除肿瘤抗原逃逸变体
Cell. 2023 Mar 30;186(7):1432-1447.e17.
doi: 10.1016/j.cell.2023.03.007.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37001503/
Abstract
癌症免疫疗法,包括过继性T细胞转移,可能因肿瘤演变为抗原丢失变异型克隆而失效。激活免疫系统的多个分支的疗法可能消除逃逸变体。在这里,我们展示了黑素瘤特异性CD4+ T细胞疗法结合OX40共刺激或CTLA-4阻断可以消除含有抗原逃逸变体的黑色素瘤。正如预期的那样,肿瘤特异性CD4+ T细胞对黑素瘤抗原的早期靶向识别是必需的。令人惊讶的是,完全的肿瘤根除依赖于中性粒细胞,部分依赖于诱导型一氧化氮合酶。支持这些发现的是,在小鼠肿瘤和接受免疫检查点阻断治疗的黑素瘤患者活检中观察到大量中性粒细胞活化。转录组和流式细胞术分析揭示了治疗小鼠中存在的一种具有抗肿瘤作用的独特中性粒细胞亚群。我们的发现揭示了一个相互作用,即介导初期抗肿瘤免疫反应的T细胞和介导抗原丢失变异型肿瘤消除的中性粒细胞之间的相互作用。
Keywords:
CTLA-4;OX40;过继性T细胞疗法;抗肿瘤中性粒细胞;抗原异质性;免疫检查点阻断;免疫治疗;中性粒细胞细胞外陷阱;中性粒细胞;肿瘤异质性。
06
Signal Transduct Target Ther. 20230428
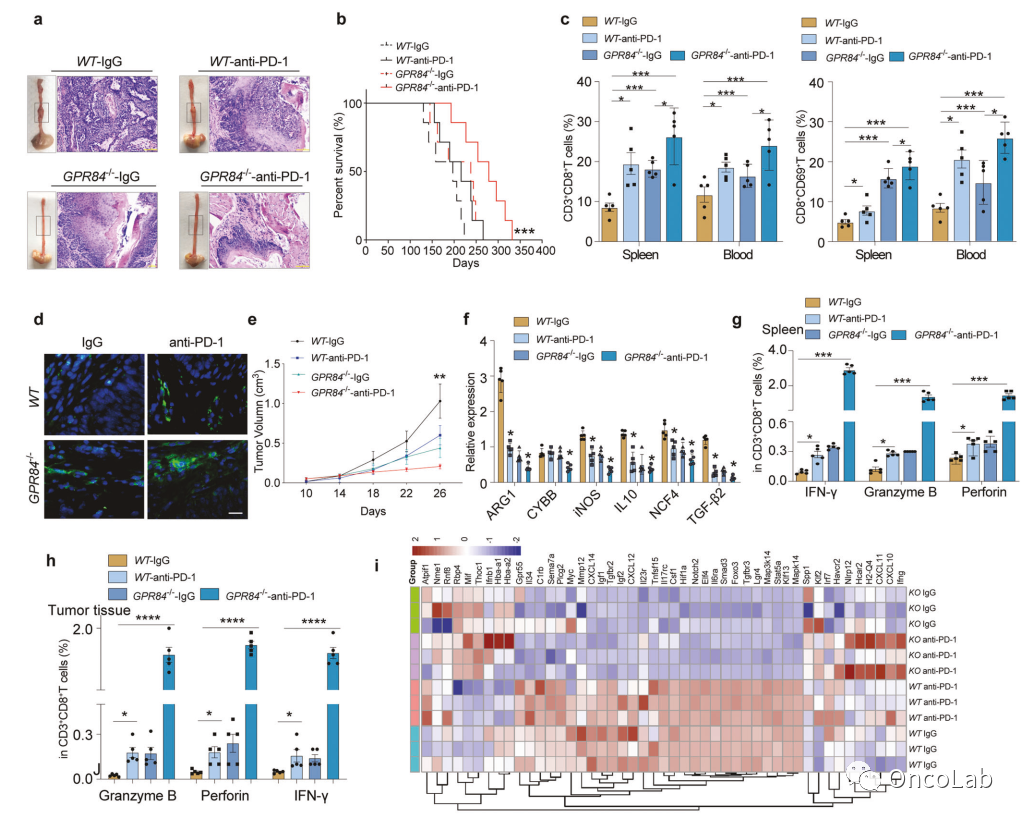
Overcoming resistance to immunotherapy by targeting GPR84 in myeloid-derived suppressor cells
通过靶向MDSC中的GPR84来克服免疫疗法的耐药性
Signal Transduct Target Ther. 2023 Apr 28;8(1):164.
doi: 10.1038/s41392-023-01388-6.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37105980/
Abstract
在肿瘤进展过程中,研究发现骨髓来源的抑制性细胞(MDSCs)在原位食管癌小鼠模型中逐渐积累。尽管已经广泛研究了MDSCs在促进肿瘤生长和抑制免疫应答中的作用,但目前仍没有针对MDSCs的有效临床靶向手段。MDSCs特异性标记物缺乏导致临床消除策略受限。本研究发现GPR84在MDSCs上独有的高表达。进一步发现,在临床样本和肿瘤小鼠模型中,GPR84在MDSCs上表达明显,通过抑制溶酶体中PD-L1的降解,驱动对CD8+T细胞的免疫抑制。此外,研究发现G-CSF和GM-CSF通过STAT3/C/EBPβ信号通路诱导GPR84表达。此外,在食管癌抗PD-1治疗耐药患者中,GPR84+MDSCs和PD-L1+MDSCs高度积累,高GPR84特征被证实为抗PD-1治疗患者总生存期的负面因素。最后,GPR84拮抗剂与抗PD-1抗体结合,增强了抗肿瘤反应。靶向GPR84增强了食管癌和其他恶性肿瘤中抗PD-1的疗效。这种联合治疗在临床肿瘤治疗中具有潜力。
07
Cancer Cell. 20230329
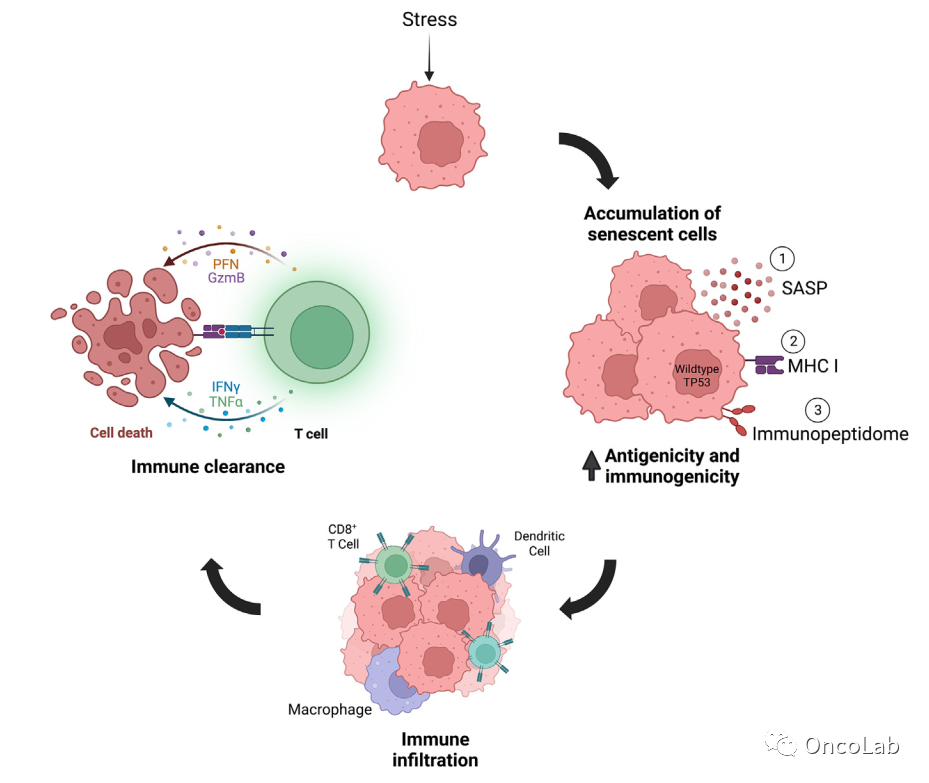
No rest for the wicked: Tumor cell senescence reshapes the immune microenvironment
恶人不休:衰老肿瘤细胞重塑免疫微环境
Cancer Cell. 2023 Mar 29;S1535-6108(23)00086-7.
doi: 10.1016/j.ccell.2023.03.013.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37059102/
Abstract
衰老会引起关键表型变化,从而调节免疫反应。Cancer Discovery (PMID: 36302222, 36302218)、Nature (PMID: 36323784) 和 Nature Cancer (PMID: 36482233) 上最近的四篇文章强调了衰老细胞(正常老化或化疗后的细胞)如何表达抗原呈现机制,呈现抗原,并与T细胞和树突状细胞相互作用,从而强烈激活免疫系统并促进抗肿瘤免疫。
08
Cell. 20230330-2
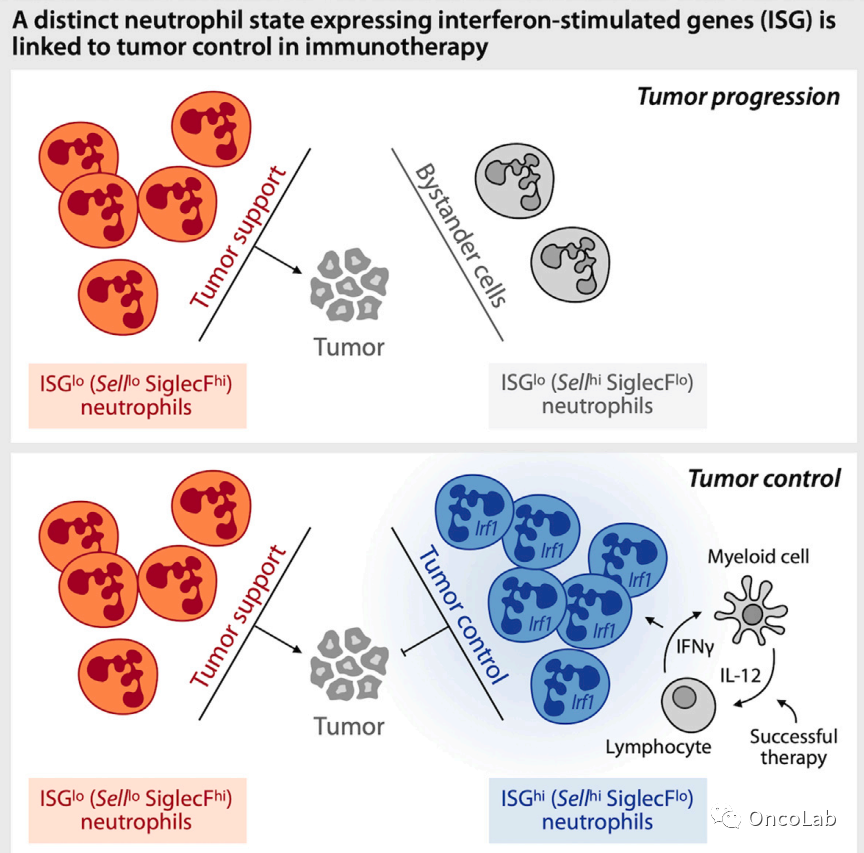
A neutrophil response linked to tumor control in immunotherapy
中性粒细胞反应参与和免疫治疗相关的肿瘤控制
Cell. 2023 Mar 30;186(7):1448-1464.e20.
doi: 10.1016/j.cell.2023.02.032.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37001504/
Abstract
中性粒细胞在实体肿瘤中积累,其丰度与预后不良相关。然而,中性粒细胞并非均质,可能在癌症治疗中发挥不同的作用。在这里,我们研究了中性粒细胞在免疫治疗中的作用,导致肿瘤受到控制。我们发现,成功的治疗急剧扩大了肿瘤中性粒细胞的数量。这种扩张可以归因于高Sell(基因名)状态,而不是促使肿瘤进展的其他中性粒细胞。治疗诱导的中性粒细胞获得了干扰素基因特征,这也出现在人类患者身上,并且对于成功的治疗至关重要,因为中性粒细胞中干扰素应答转录因子IRF1的丧失导致免疫治疗失败。中性粒细胞反应依赖于抗肿瘤免疫的关键组件,包括依赖于BATF3的DCs、IL-12和IFNγ。此外,我们发现治疗诱导的全身性中性粒细胞反应与肺癌患者的疾病结局呈正相关。因此,我们确立了中性粒细胞状态在有效癌症治疗中发挥关键作用。
Keywords:
IRF1;SiglecF;抗CD40;抗PD-1;癌症;免疫治疗;干扰素;肺癌;中性粒细胞;单细胞RNA-seq。
09
J Hematol Oncol. 20230413
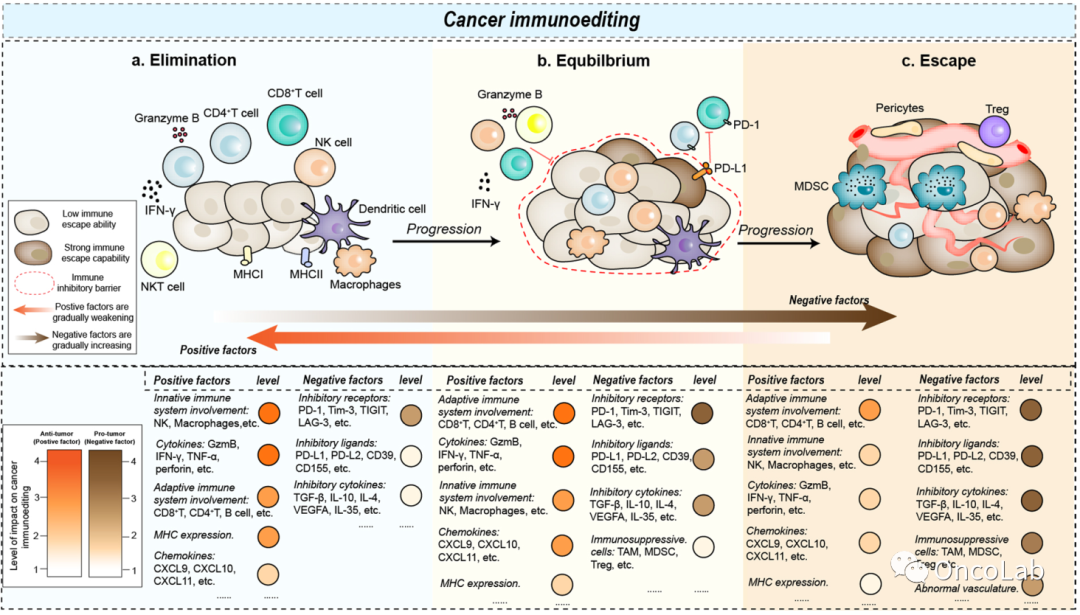
Novel strategies for cancer immunotherapy: counter-immunoediting therapy
癌症免疫疗法新策略:逆向免疫编辑疗法
J Hematol Oncol. 2023 Apr 13;16(1):38.
doi: 10.1186/s13045-023-01430-8.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37055849/
Abstract
免疫疗法的出现在癌症治疗领域留下了不可磨灭的印记,特别是在临床实践中应用免疫检查点抑制剂。尽管免疫疗法在一些肿瘤中证明了其疗效和安全性,但许多患者仍然对免疫疗法存在先天性或获得性耐药性。这种现象的出现与肿瘤细胞经过癌症免疫编辑后形成的高度异质性免疫微环境密切相关。癌症免疫编辑过程是指肿瘤细胞和免疫系统之间的合作互动,包括三个阶段:消除、平衡和逃逸。在这些阶段,免疫系统与肿瘤细胞之间的相互作用产生了复杂的免疫微环境,从而导致肿瘤细胞获得不同水平的免疫治疗耐药性。在这篇综述中,我们总结了癌症免疫编辑的不同阶段的特点及相应的治疗工具,并提出了基于免疫表型的规范化治疗策略。通过针对癌症免疫编辑不同阶段的靶向干预,使癌症免疫编辑过程逆转,在精确治疗背景下使免疫治疗成为治愈癌症最有前景的疗法。
10
Dev Cell. 20230406
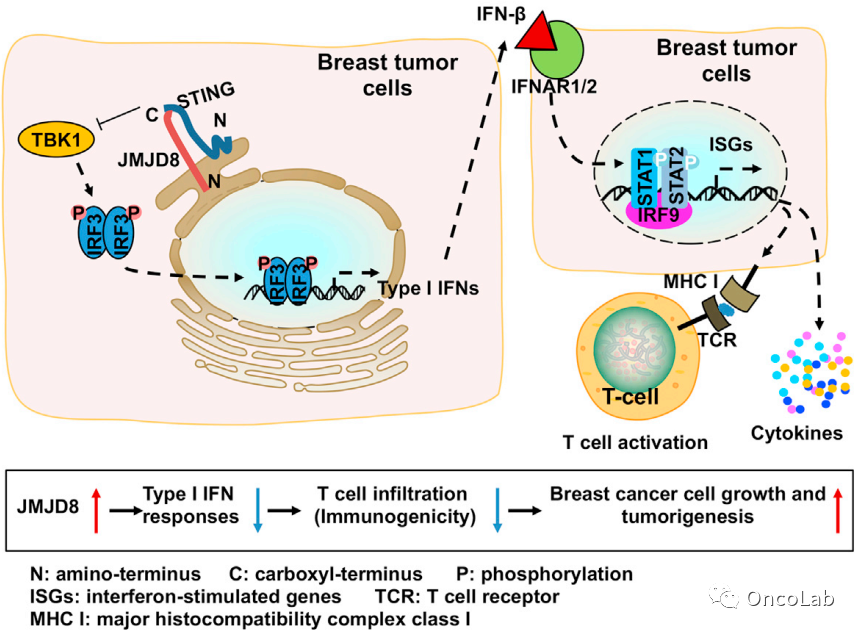
ER-localized JmjC domain-containing protein JMJD8 targets STING to promote immune evasion and tumor growth in breast cancer
位于内质网的JmjC结构域蛋白JMJD8靶向STING以促进乳腺癌的免疫逃逸和肿瘤生长
Dev Cell. 2023 Apr 6;S1534-5807(23)00131-4.
doi: 10.1016/j.devcel.2023.03.015.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37054705/
Abstract
已知STING介导的I型干扰素(IFN)信号通路在抗肿瘤免疫中起着关键作用。在这里,我们证明了一种内质网(ER)定位的JmjC结构域蛋白,JMJD8,抑制STING诱导的I型IFN反应,以促进免疫逃避和乳腺肿瘤发生。在机制上,JMJD8与TBK1竞争与STING结合,阻止STING-TBK1复合物的形成,限制I型IFN和IFN刺激基因(ISG)的表达以及免疫细胞的浸润。JMJD8的敲低提高了化疗和免疫检查点治疗在治疗人类和小鼠乳腺癌细胞来源的移植瘤时的有效性。临床相关性在于JMJD8在人类乳腺肿瘤样本中高度表达,其表达与I型IFN和ISGs以及免疫细胞浸润呈负相关。总的来说,我们的研究发现JMJD8调节I型IFN反应,靶向JMJD8触发抗肿瘤免疫。
Keywords:
JMJD8;STING;抗肿瘤免疫;乳腺癌;I型IFN信号通路。
11
Nat Rev Cancer. 20230412
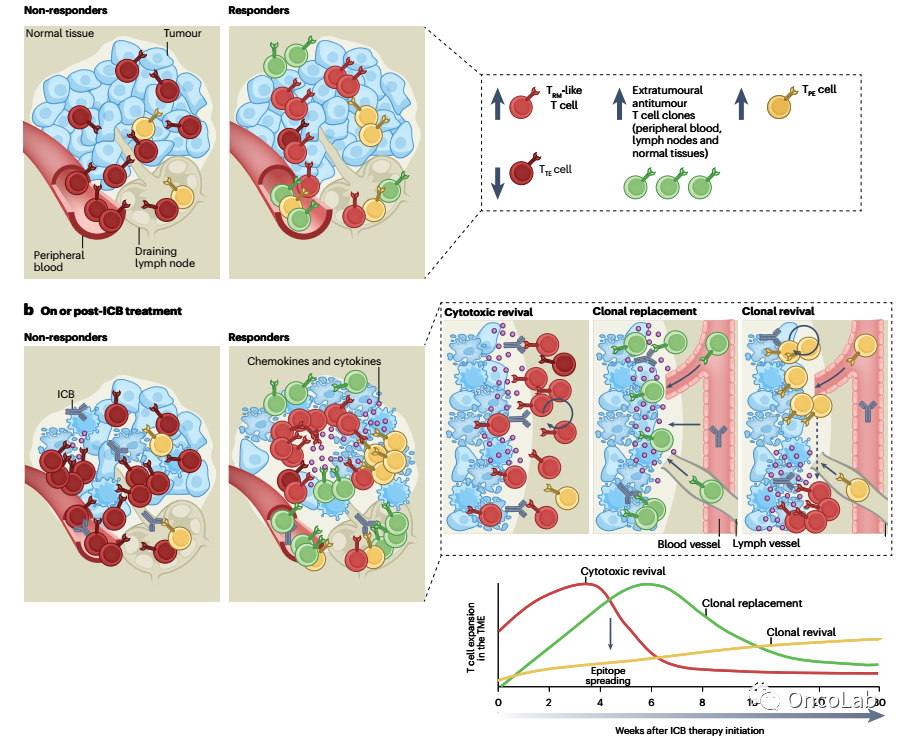
Dynamics and specificities of T cells in cancer immunotherapy
肿瘤免疫治疗中T细胞的动态和特异性
Nat Rev Cancer. 2023 Apr 12.
doi: 10.1038/s41568-023-00560-y.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37046001/
Abstract
近年来,肿瘤免疫治疗的进展,从免疫检查点阻断疗法到免疫细胞治疗和疫苗,已经彻底改变了肿瘤治疗模式。然而,临床对这些药物反应的变化激发了人们对T细胞在免疫干预下如何演变的浓厚兴趣。在过去的十年里,多维单细胞技术的出现为解析肿瘤微环境中淋巴细胞的细胞状态提供了空前的能力。特别是,通过T细胞受体(TCR)确定肿瘤内表型与T细胞抗原特异性之间关联的能力快速扩展,使得现在可以专注于研究具有肿瘤特异性反应的T细胞的性质。此外,TCR克隆性的评估使得可以采用分子方法在免疫治疗干预过程中追踪抗肿瘤T细胞的轨迹、克隆动态和表型变化。在这里,我们回顾了抗肿瘤T细胞的细胞状态和抗原特异性的现有知识,并研究了如何通过对患者T细胞动态的细致分析,为揭示有效肿瘤免疫治疗背后的机制提供有意义的见解。我们重点关注了与T细胞反应相关的T细胞亚群,并讨论了不同免疫治疗如何利用已存在的肿瘤反应性T细胞库或引导抗肿瘤特异性的产生。下一步的研究将旨在阐明与产生有效抗肿瘤T细胞免疫相关的因素,这将指导更有效的治疗策略的设计。
12
Cell. 20230404
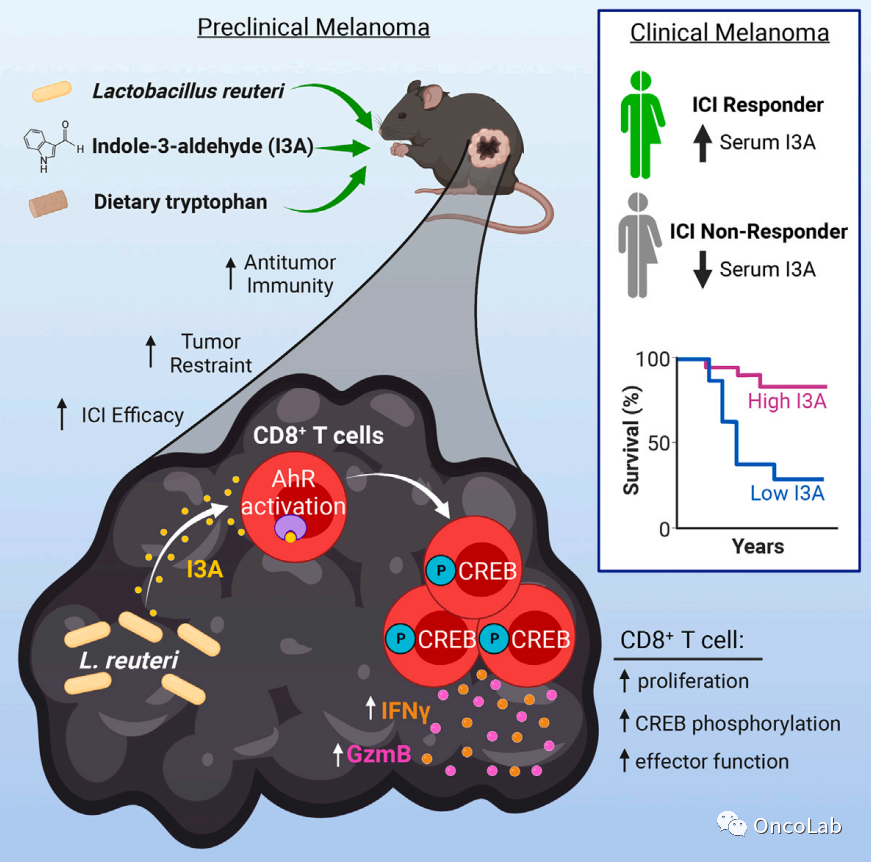
Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment
瘤内罗伊氏乳杆菌释放的膳食色氨酸代谢物促进免疫检查点抑制剂治疗
Cell. 2023 Apr 4;S0092-8674(23)00271-4.
doi: 10.1016/j.cell.2023.03.011.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37028428/
Abstract
癌症患者使用益生菌的情况越来越普遍,包括那些接受免疫检查点抑制剂(ICI)治疗的患者。在这里,我们阐明了益生菌释放的芳香烃受体(AhR)激动剂吲哚-3-醛(I3A)与肿瘤微环境中的CD8 T细胞之间的关键微生物宿主相互作用,这种相互作用在临床前黑色素瘤中强烈增强抗肿瘤免疫并促进ICI。我们的研究发现,益生菌Lactobacillus reuteri(Lr)迁移到黑色素瘤中,定植并在其中持续存在,通过释放的膳食色氨酸代谢物I3A,在局部促进干扰素-γ产生的CD8 T细胞,从而增强ICI。此外,Lr分泌的I3A是驱动抗肿瘤免疫的必要和充分条件,而CD8 T细胞中AhR信号传导的丧失会抵消Lr的抗肿瘤作用。进一步研究发现,富含色氨酸的饮食增强了Lr和ICI诱导的抗肿瘤免疫反应,这取决于CD8 T细胞的AhR信号。最后,我们为I3A在促进晚期黑色素瘤患者的ICI疗效和生存提供了证据。
Keywords:
乳酸杆菌;芳香烃受体;免疫检查点抑制剂;吲哚-3-醛;黑色素瘤;微生物AhR配体;微生物-宿主相互作用;色氨酸;肿瘤菌群。
13
Sci Adv. 20230407
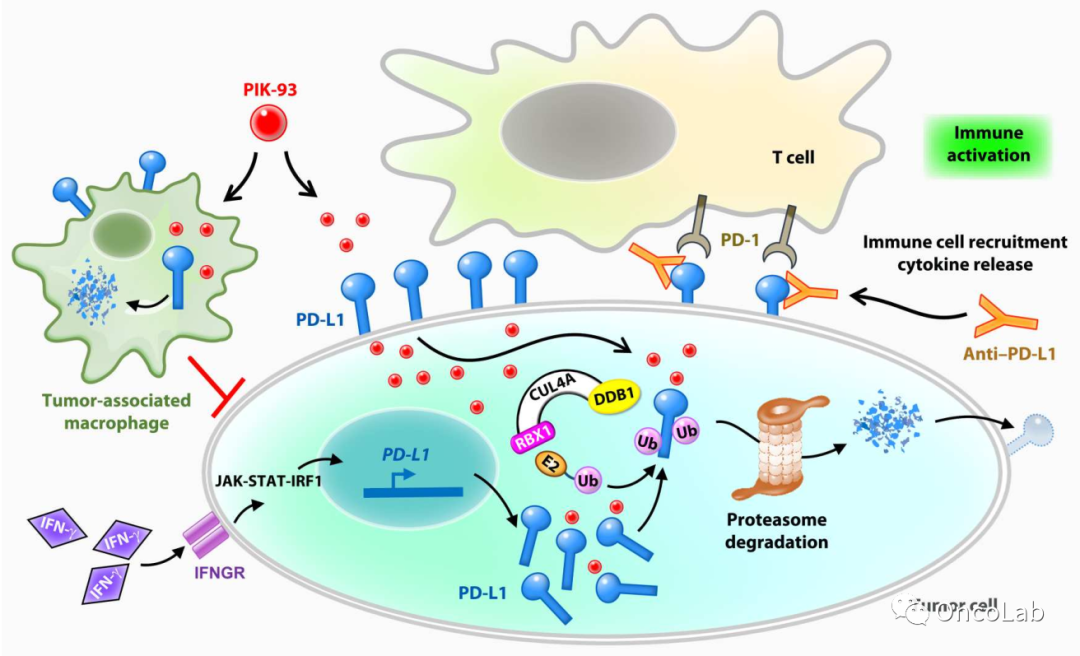
Small-molecule PIK-93 modulates the tumor microenvironment to improve immune checkpoint blockade response
小分子PIK-93调节肿瘤微环境以提高免疫检查点阻断反应
Sci Adv. 2023 Apr 7;9(14):eade9944.
doi: 10.1126/sciadv.ade9944.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37027467/
Abstract
针对PD-L1的免疫检查点抑制剂(ICI)免疫治疗是治疗晚期非小细胞肺癌(NSCLC)的最先进方法。然而,由于不利的肿瘤微环境(TME)和基于抗体的ICI渗透性较差,部分NSCLC患者的治疗反应不尽如人意。在本研究中,我们旨在发现可以调节TME以提高NSCLC体外和体内ICI治疗效果的小分子药物。我们使用基于细胞的全局蛋白质稳定性(GPS)筛选系统,鉴定出一个PD-L1蛋白调节小分子PIK-93。PIK-93通过增强PD-L1-Cullin-4A相互作用促使PD-L1泛素化。PIK-93降低了M1巨噬细胞上的PD-L1水平并增强了M1抗肿瘤细胞毒性。结合PIK-93和抗PD-L1抗体治疗增强了T细胞激活,抑制了肿瘤生长,并增加了同基因和人外周血单个核细胞(PBMC)系衍生的异种移植小鼠模型中肿瘤浸润性淋巴细胞(TIL)的招募。PIK-93与抗PD-L1抗体结合时促使一个有利于治疗的TME,从而增强PD-1/PD-L1阻断癌症免疫治疗。
14
Trends Biochem Sci. 20230418
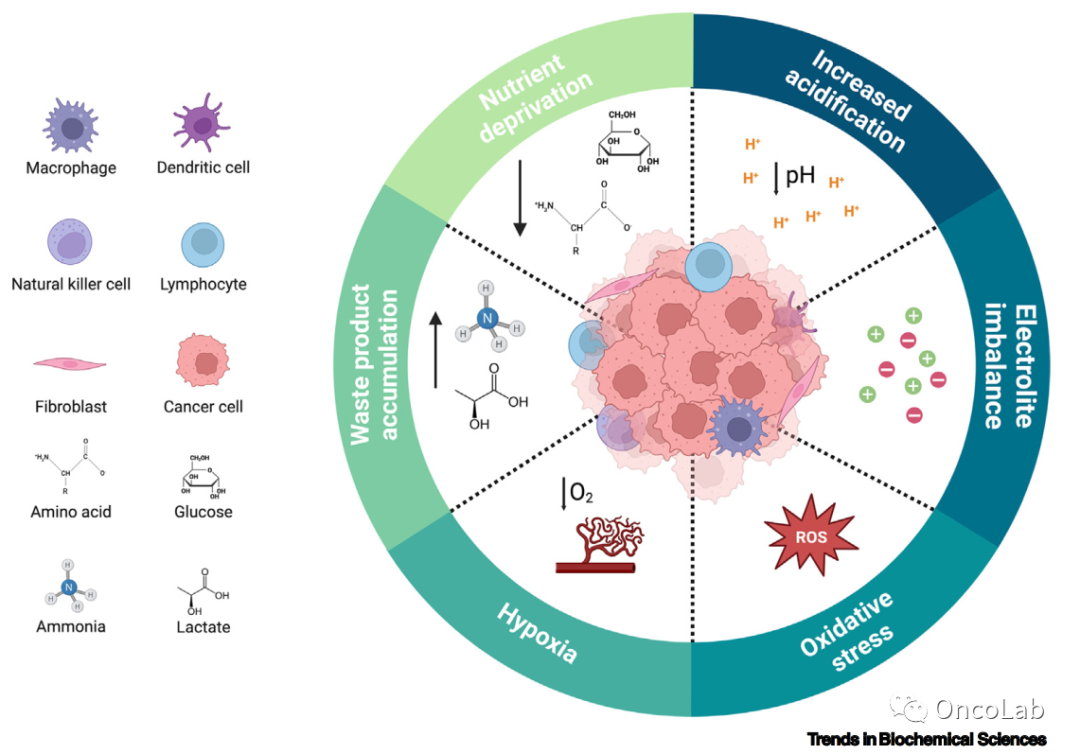
The metabolic cross-talk between cancer and T cells
肿瘤与T细胞之间的代谢相互作用
Trends Biochem Sci. 2023 Apr 18;S0968-0004(23)00080-4.
doi: 10.1016/j.tibs.2023.03.004.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37080875/
Abstract
肿瘤细胞与T细胞之间的代谢相互作用决定了癌症的形成和进展。这些细胞具有代谢可塑性。因此,它们调整自己的代谢特征以满足表型需求。然而,肿瘤的营养微环境是一个非常恶劣的生态位,这些细胞被迫争夺可用的营养物质。肿瘤细胞的高活性代谢经常在促进具有肿瘤促进作用的耗竭CD8+ T细胞和调节性T细胞(Treg)的同时,与具有抗肿瘤作用的CD8+ T细胞竞争。因此,癌细胞逃避免疫应答并失去控制地扩散。识别必要的代谢途径以将平衡从肿瘤促进型转变为抗肿瘤型免疫表型对于增强抗肿瘤免疫至关重要。
Keywords:
抗肿瘤T细胞;免疫代谢;肿瘤促进型T细胞;肿瘤微环境。
15
Nature. 20230419
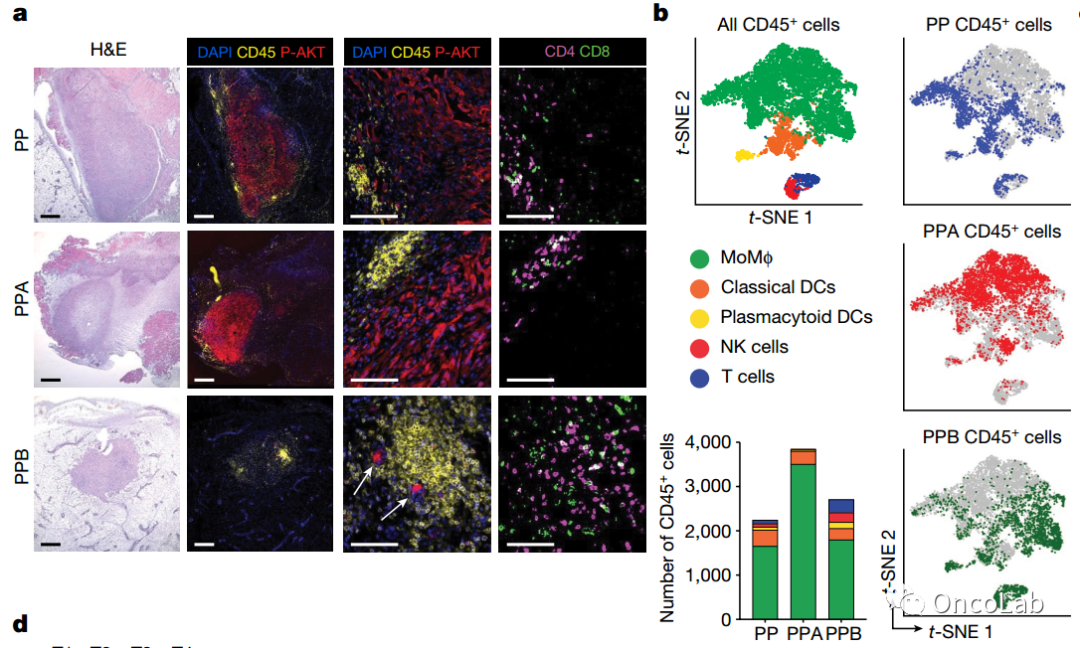
PTEN缺失乳腺肿瘤中的PI3Kβ调控免疫逃避
PTEN缺失乳腺肿瘤中的PI3Kβ调控免疫逃避
Nature. 2023 Apr 19.
doi: 10.1038/s41586-023-05940-w.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37076617/
Abstract
PTEN肿瘤抑制基因的丧失是所有癌症类型中最常见的致癌驱动因素之一。PTEN是PI3K信号传导的主要负向调节器。已经证明,PI3Kβ亚型在PTEN缺失肿瘤中起着重要作用,但PI3Kβ活性的重要性背后的机制尚不清楚。在这里,我们使用一种基因工程小鼠模型,通过敲除Pten和Trp53(编码p53)来研究侵袭性乳腺癌,发现PI3Kβ的基因失活导致了强烈的抗肿瘤免疫应答,这种应答在免疫功能正常的小鼠中抑制了肿瘤生长,但在免疫缺陷小鼠中没有这种效果。从机制上讲,PTEN缺失背景下的PI3Kβ失活导致STAT3信号减弱,并增加了免疫刺激分子的表达,从而促进了抗肿瘤免疫应答。药物干预的PI3Kβ抑制也诱发了抗肿瘤免疫,并与免疫治疗协同作用抑制肿瘤生长。在联合治疗中完全应答的小鼠表现出免疫记忆,并在再次接种时排斥肿瘤。我们的研究揭示了一个连接PTEN丧失和STAT3激活的分子机制,并表明PI3Kβ在PTEN缺失肿瘤中控制免疫逃避,为将PI3Kβ抑制剂与免疫治疗相结合治疗PTEN缺失乳腺癌提供了合理性。
16
Nucleic Acids Res. 20230418
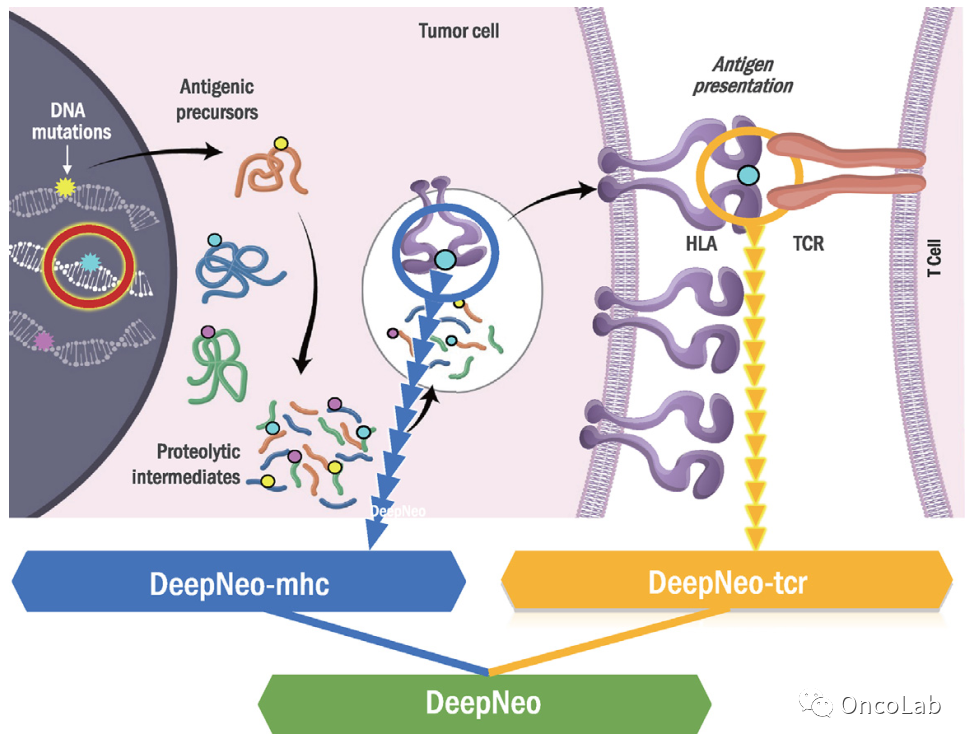
DeepNeo: a webserver for predicting immunogenic neoantigens
DeepNeo:一个用于预测免疫原性新抗原的在线工具
Nucleic Acids Res. 2023 Apr 18;gkad275.
doi: 10.1093/nar/gkad275.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37070174/
Abstract
非自体表位,无论是来源于外来物质还是体细胞突变,在被主要组织相容性复合物(MHC)分子呈递并被T细胞识别时引发免疫应答。鉴定具有免疫活性的新表位在癌症和病毒医学中具有重要意义。然而,目前的方法主要局限于预测突变肽与MHC的物理结合。我们之前开发了一个基于深度学习的模型DeepNeo,通过捕获具有T细胞反应性的肽-MHC配对的结构特性来识别免疫原性新表位。在这里,我们使用最新的训练数据升级了我们的DeepNeo模型。升级后的模型(DeepNeo-v2)在评估指标上得到了改进,并展示了更符合已知新抗原行为的预测得分分布。免疫原性新抗原预测可以在https://deepneo.net上进行。
17
J Hematol Oncol. 20230417
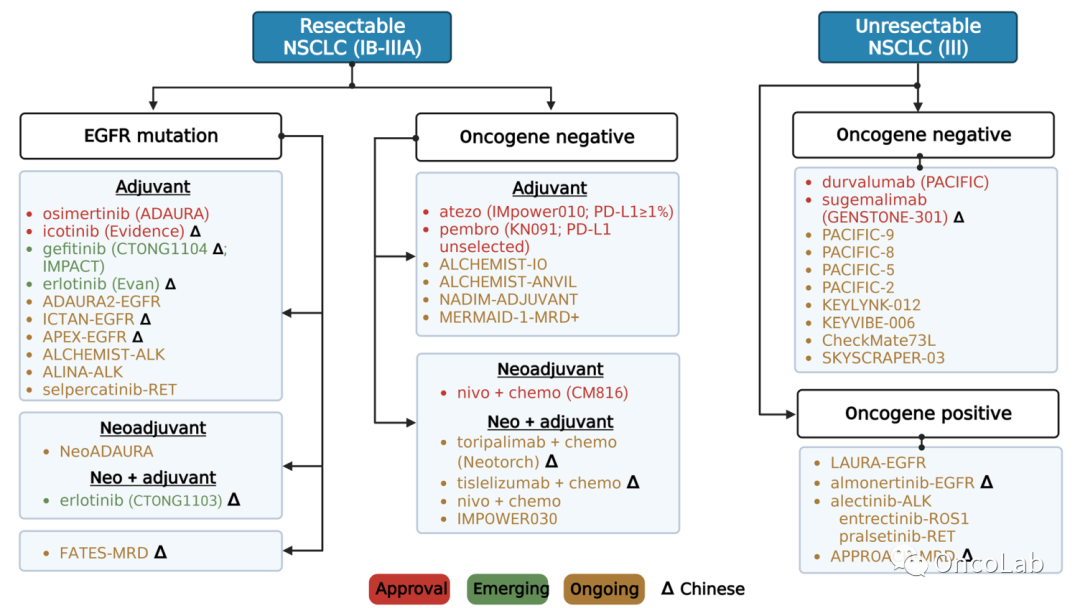
Emerging evidence and treatment paradigm of non-small cell lung cancer
非小细胞肺癌治疗研究进展
J Hematol Oncol. 2023 Apr 17;16(1):40.
doi: 10.1186/s13045-023-01436-2.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37069698/
Abstract
非小细胞肺癌(NSCLC)生物标志物驱动疗法和免疫检查点阻断研究正在迅速发展。临床试验的广度和深度也以前所未有的速度显著提高。个性化治疗范式每年都在不断演变。在本综述中,我们总结了改变了所有阶段NSCLC患者治疗范式的有前景的药物,包括靶向治疗和使用检查点抑制剂的免疫治疗。根据最近的证据,我们为NSCLC提出治疗算法,并提出了一些尚未解决的临床问题,这些问题正在进行的临床试验中得到探讨。这些试验的结果可能会影响未来的临床实践。
18
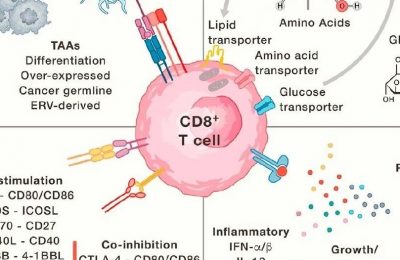
Cell. 20230413-1
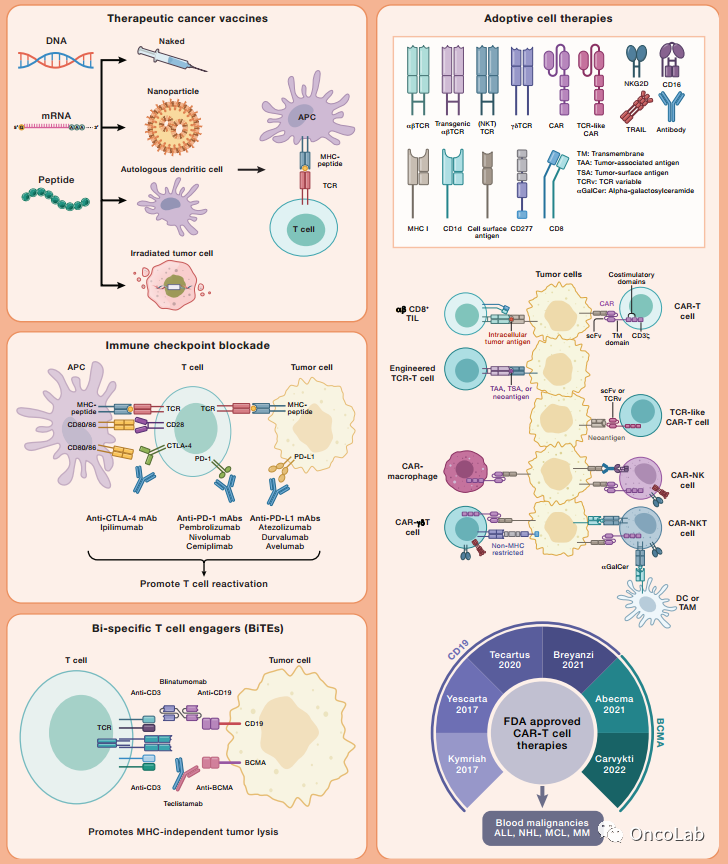
Advances in cancer immunotherapies
癌症免疫治疗的进展
Cell. 2023 Apr 13;186(8):1814-1814.e1.
doi: 10.1016/j.cell.2023.02.039.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37059073/
Abstract
促使免疫系统识别和消除癌细胞的治疗方法,即癌症免疫治疗,已经成为癌症治疗的一个独特支柱。其中最具前景的治疗方法包括治疗性疫苗、免疫检查点阻断、双特异性T细胞诱导剂(BiTEs)和过继性细胞治疗。这些方法具有共同的作用机制,即诱导针对肿瘤抗原的T细胞为基础的免疫反应,无论是内源性还是工程性,但是先天免疫系统(尤其是抗原呈现细胞)与免疫效应细胞之间的相互作用也是癌症免疫治疗有效性的基础,目前还在开发与这些细胞相互作用的方法。要查看此SnapShot,请打开或下载PDF。
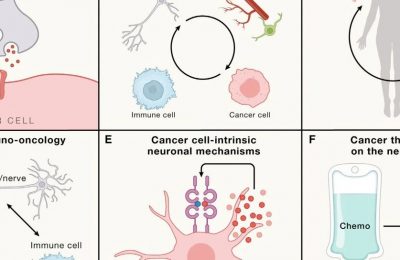
19
Cell. 20230413-2
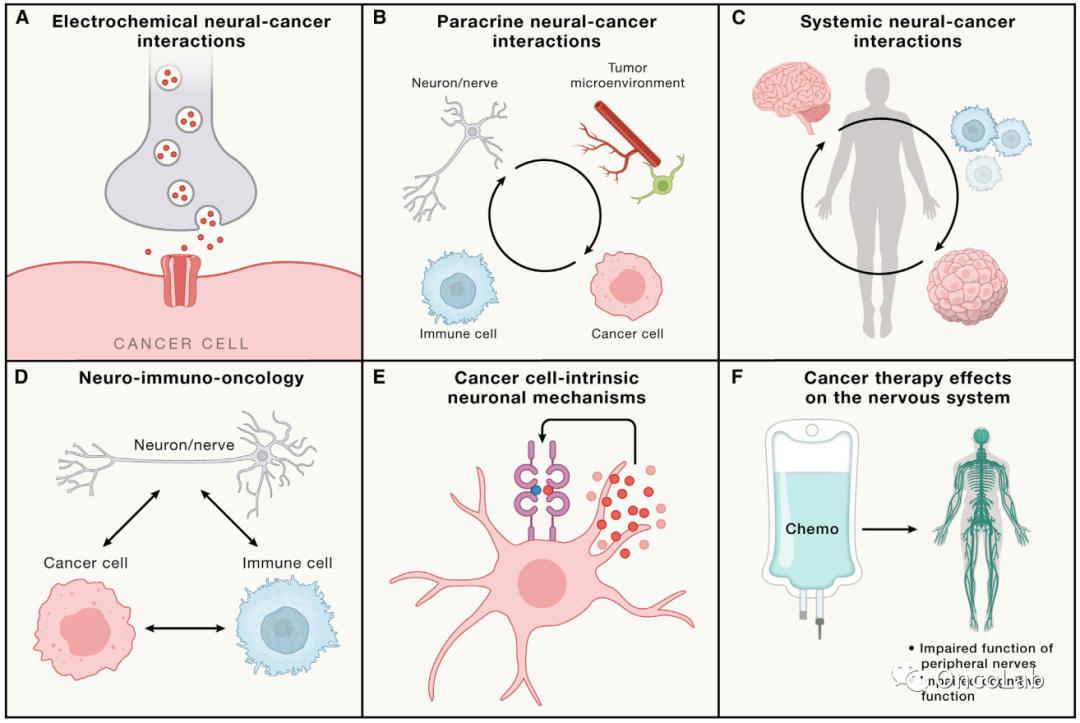
Cancer neuroscience: State of the field, emerging directions
癌症神经科学:现状与新兴方向
Cell. 2023 Apr 13;186(8):1689-1707.
doi: 10.1016/j.cell.2023.02.002
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37059069/
Abstract
神经系统既主导个体发育,也调控肿瘤形成。神经系统在发育过程中调节器官发生,维持体内稳态,并在整个生命过程中促进可塑性,与此同时在癌症调控中发挥类似作用。基础研究发现,神经元与癌细胞之间存在直接的旁分泌和电化学通信,而在广泛的恶性肿瘤中,神经系统对免疫系统和肿瘤微环境中的基质细胞的影响也存在间接相互作用。神经系统与癌症之间的相互作用可调节癌症发生、生长、侵袭和转移、治疗耐受性、刺激促肿瘤炎症的发生以及损害抗癌免疫。癌症神经科学的进展可能为癌症治疗创造一个重要的新支柱。
20
Cell. 20230413-3
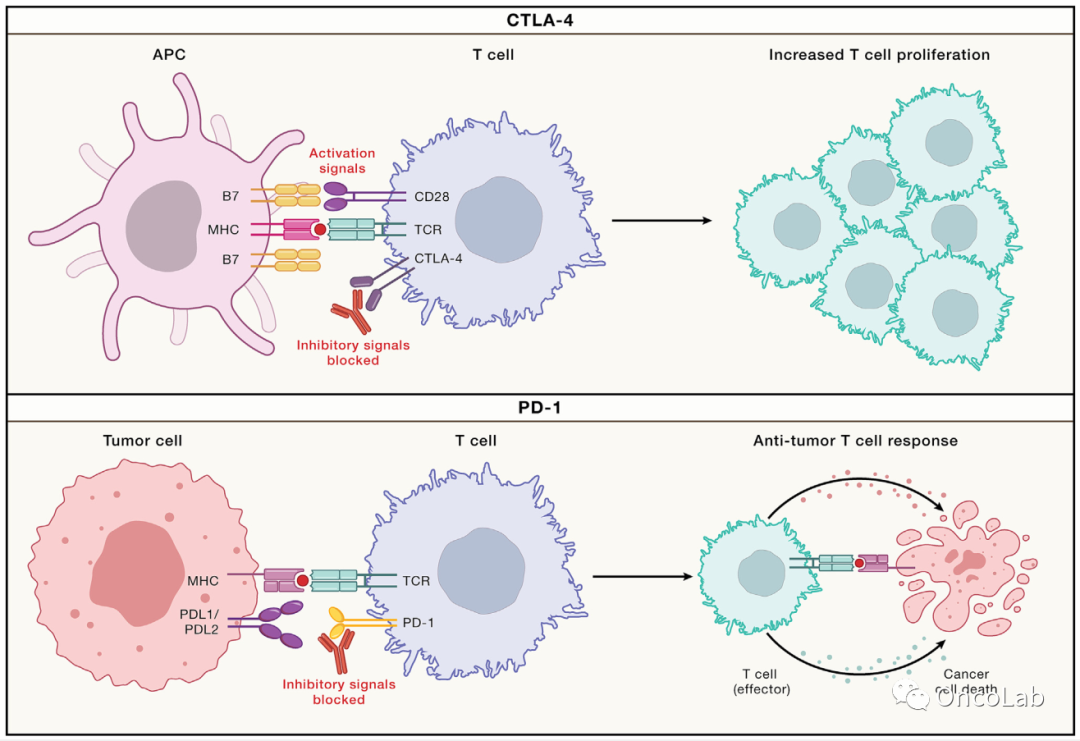
Immune checkpoint therapy-current perspectives and future directions
免疫检查点治疗:当前观点和未来方向
Cell. 2023 Apr 13;186(8):1652-1669.
doi: 10.1016/j.cell.2023.03.006.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37059068/
Abstract
免疫检查点治疗(ICT)已极大地改善了癌症患者的临床结局,为部分患者带来了持久的临床益处,甚至治愈。不同肿瘤类型的反应率差异以及优化患者筛选的预测生物标志物需求以最大化疗效和最小化毒性,促使人们努力研究调节ICT反应的免疫和非免疫因素。本综述重点介绍了抗肿瘤免疫应答及其在ICT中的应答和耐药性背后的生物学原理,讨论了解决ICT当前挑战的努力,并概述了指导ICT后续临床试验和联合治疗策略的方向。
Keywords:
CTLA-4;ICT;PD-1;PD-L1;联合生物标志物;细胞毒性T淋巴细胞相关蛋白4;免疫检查点治疗;免疫相关不良事件;irAEs;程序性细胞死亡蛋白1;程序性死亡配体1;逆向翻译。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏