肿瘤特异性的CD8+ T细胞是在免疫对抗癌症的战斗中的强力效应因子,但它们通常受到由肿瘤微环境引发的功能障碍/耗竭的限制。Rudloff等人通过比较肿瘤和急性感染模型中抗原特异性CD8+ T细胞的分化、细胞分裂和染色质可及性,研究了这种功能障碍。他们发现肿瘤中的功能障碍编程很早就开始了,并且在长时间接触肿瘤/肿瘤抗原后进一步发展。他们的结果最近发表在《Nature Immunology》上。
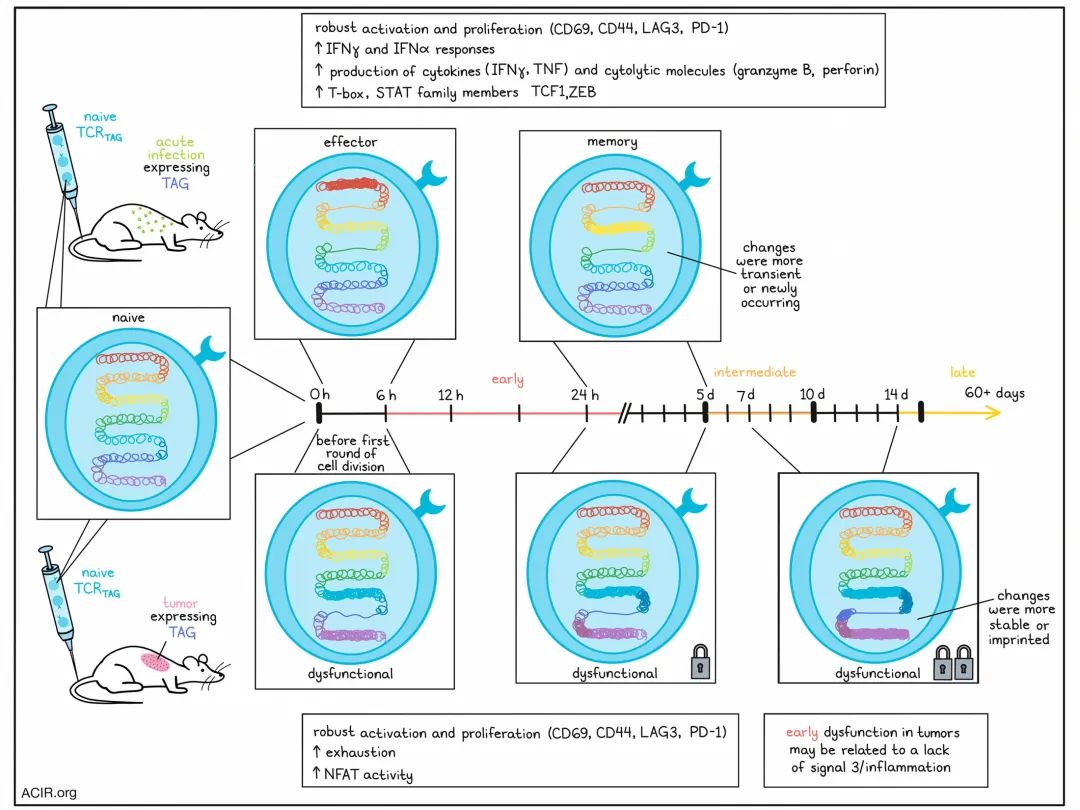
Rudloff等人之前已经发表了关于肿瘤引发功能障碍特征的研究结果,他们利用他们已经建立的肝癌发生模型来跟踪肿瘤特异性CD8+ T细胞的分裂和分化过程。用CFSE标记对TAG(SV40大T抗原)特异性的初代CD8+ T细胞,并将其转移到表达TAG的肿瘤或表达TAG表位的李斯特菌感染的小鼠体内。在这两种模型中,TCRTAG阳性T细胞(TCRTAG)都能强烈分裂、扩增,并上调激活标记,包括CD69、CD44、LAG3和PD-1。然而,与急性感染模型的细胞不同,肿瘤模型的细胞未能产生效应细胞因子(IFNγ和TNF)或细胞毒性分子(颗粒酶B和穿孔素),并且在体外重新刺激后没有显示脱颗粒(CD107a膜定位)的证据。即使在第一轮细胞分裂之前的6小时时间点,这些差异也已明显。此时间点,TOX还未被诱导,这暗示它可能并非导致效应功能受损的原因。
为了评估早期功能障碍是否与刺激不足有关,研究人员测试了已经激活的效应T细胞在暴露于肿瘤环境后是否会变得功能障碍。当时间相匹配的急性感染模型的效应TCRTAG T细胞被过继转移到肿瘤模型时,它们继续增殖,但在12小时内开始丧失产生细胞因子(先是TNF,然后是IFNγ)的能力,一周内完全丧失了产生细胞因子的能力。相比之下,当效应TCRTAG被过继转移回急性感染模型时,它们仍然是IFNγ/TNF双重产生者,这表明肿瘤环境可以覆盖已建立的效应编程。这些研究的结果在使用B16-OVA和OT-I细胞的肺转移模型中得到了验证,表明这些发现并非特定于肿瘤起源、组织或目标抗原。
接下来,Rudloff等人将他们的注意力转向了表观遗传重塑。通过使用RNA和ATACseq,研究人员发现,肿瘤和急性感染模型中的TCRTAG在6小时内就表现出不同的染色质可及性和基因表达谱,且大部分变化发生在最初的6小时,而不是在12和24小时。基因集和基因图谱富集分析显示,虽然两种模型中的TCRTAG相对于初代小鼠都显示出了激活和TCR信号传导的证据,但来自急性感染模型的TCRTAG显示出了STAT家族成员活性的增加和IFNα和IFNγ反应的富集。另一方面,来自肿瘤模型的TCRTAG显示出了与耗竭相关的染色质的可及性增加。他们也显示出了NFAT家族成员活动的增加,这与多种抑制性受体的表达和后期的TOX表达一致,并且表现出在没有信号3的情况下T细胞通常表达的基因富集特征。这些结果表明,虽然两种模型中的TCR刺激相似,但肿瘤模型中的功能障碍可能与刺激激活期间炎症细胞因子信号不足有关。
基因集富集分析揭示,在急性感染中,早期的TCRTAG(在最初的6、12或24小时内分离)富集了与晚期效应和记忆表型相关的基因集,而在肿瘤模型中,早期的TCRTAG富集了与肿瘤或慢性感染中常见的晚期T细胞功能障碍相关的基因集。研究人员利用他们当前和以前发布的数据,发现肿瘤中的TCRTAG的染色质可及性根据肿瘤暴露的持续时间分为三组:早期(6-24小时)、中期(5-10天)和晚期(14-60+天)。在这里,最大数量的染色质可及性差异峰出现在6小时内,另一个大轮的变化在24小时到5天之间,第三个较小的轮次在7到14天之间。然而,第5天的染色质可及性特性的近一半在最初的6小时内就已经建立,并保持一致。在感染模型中,TCRTAG只观察到两轮主要的变化(在6小时内和在24小时到5天之间),许多变化是短暂的或在24小时到5天之间新发生的,而在第5天之后只有少数变化显现出来,这表明这些细胞可能在病原体/抗原清除后建立了记忆样状态。
通过使用monaLisa分析,研究人员确定了NFAT富集是肿瘤中过渡峰值变化的关键驱动因素,这与引发耗竭的表型一致,而T-box TF家族是急性感染中峰值变化的驱动因素,这与引发效应功能和建立记忆细胞亚群一致。在两种模型中,这些变化在6小时内就已经建立,并在24小时到5天之间得到了加强。
为了测试肿瘤诱导的变化在多大程度上是可逆的,研究人员在不同时间点从肿瘤中分离出TCRTAG,并将它们“停放”在无肿瘤的小鼠体内。当细胞从肿瘤中较早分离出来时,它们更有可能下调PD-1并开始产生细胞因子,而不是在后期时间点从肿瘤中移除,这表明效应功能损失的特征随着对肿瘤/肿瘤抗原的持续暴露而增加。
这种印记也反映在染色质可及性数据中,这些数据显示,早期时间点的肿瘤中的TCRTAG峰值更具暂时性,但随着肿瘤暴露时间的增加变得更稳定。它还显示出“停放”前的样本与停放后的样本以及经历过抗原的记忆T细胞分别聚类。PD-1很快就被印记,而TOX印记则是后来建立的。在停放第5天的TCRTAG中,已经占主导地位的是KLF家族特征,这些特征在T细胞的静止、功能限制和固定功能障碍中有描述的作用,而TCF1和ZEB家族图案(在记忆群体中明显)则缺乏。然而,NFAT TF富集在停放后很快就被逆转,这表明它可能是由连续的TCR信号维持的。总的来说,这些结果表明,虽然在早期和中期时间点从肿瘤中移出功能障碍的TCRTAG可能会逆转某些染色质的重塑和抑制分子的表达,但是效应功能不太可能恢复,因为诱导效应和记忆功能的转录因子没有被表达。
总的来说,这些结果显示,功能障碍的表观遗传编程在抗原遭遇后的几小时内开始,在肿瘤中的抗原特异性CD8+ T细胞的第一次细胞分裂之前开始,随着对肿瘤抗原的持续暴露经过数日或数周而进一步加强。虽然部分这种功能障碍编程在早期是可逆的,但是在没有干预的情况下,效应功能不太可能恢复。
本周,通讯作者Mary Philip和第一作者Michael W. Rudloff回答了我们的问题。
对你来说,这项研究中最令人惊讶的发现是什么?
MP:在研究开始时,我认为在肿瘤中激活的CD8+ T细胞最初会是功能性的,但在每次细胞分裂过程中会逐渐失去功能。然而,令我非常惊讶的是,在经历他们的第一次细胞分裂之前,肿瘤特异性T细胞几乎已经失去了全部的细胞毒性能力。
MWR:我被T细胞激活后几小时内就能发生多少表观遗传和转录变化所震惊。看到如此大规模的染色质重塑事件如此快速地发生,让我感到惊奇,同时也挑战了我对生物过程在体内能发生多快的认知。
这一发现对我们有怎样的提示?
MP:免疫检查点阻断就像是从T细胞上摘下刹车,但我们的工作表明,肿瘤特异性T细胞可能一开始就没有移动。我们需要新的策略来启动肿瘤中的T细胞,例如,提供外源性的先天免疫信号,或者工程化T细胞以提供自己的炎症信号。
MWR:鉴于即使是之前功能正常的效应CD8+ T细胞也能迅速失去细胞毒性能力,我们可能需要实施不仅能增加细胞毒性T细胞的数量,而且能延长每个细胞在肿瘤中浸润和激活的抗肿瘤免疫持续时间的方法。
在工作之外,你最近学到或了解到的最酷的事情是什么?
MP:这个夏天我一直在学习弹奏立式双低音提琴,这很酷,因为你不仅能听到音乐,而且真的能感觉到那些美丽的低音通过整个乐器和地板的共振。
MWR:今年夏天我最小的孩子开始爬行和行走,所以我和我的妻子正在体验两个非常活跃的幼儿带来的乐趣和兴奋。
来源 | ACIR.ORG & Nat Immunol.

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab