往期链接
01
J Clin Invest. 20230801
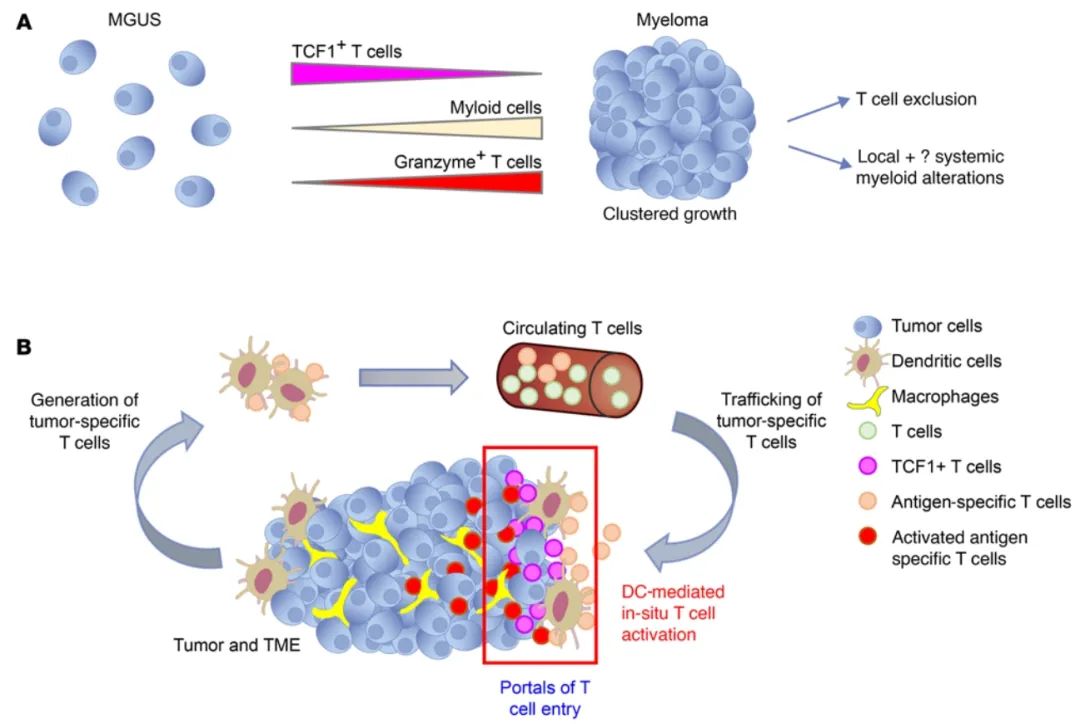
多发性骨髓瘤和癌前病变中抗原特异性T细胞浸润和空间结构的调节
J Clin Invest. 2023 Aug 1;133(15):e167629.
doi: 10.1172/JCI167629.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37526080/
内容简介
抗原特异性T细胞进入人体肿瘤对于免疫疗法至关重要,但其底层机制尚不清楚。在此,我们结合高维空间分析以及体内外模型研究了人类多发性骨髓瘤(MM)及其前体疾病单克隆性未定性伽玛球蛋白病(MGUS)中免疫浸润的机制。集群肿瘤生长是MM的特征,但未在MGUS活检中出现,而这种生长模式在人源化小鼠模型中得到复制。MM活检显示出肿瘤内部以及空间异质性,存在富含T细胞和稀少T细胞的区域并存,以及T细胞排斥区的存在。体外研究表明,T细胞进入MM集群是由激动信号和CD2-CD58相互作用调控的。在T细胞过继转移后,特异性T细胞定位至肿瘤部位,但需要原位DC介导的抗原呈递才能进入肿瘤。C型凝集素领域家族9成员A阳性(CLEC9A+)DC似乎标记了MM活检中T细胞浸润梯度的入口,它们与T细胞因子1阳性(TCF1+)T细胞的相邻程度与疾病状态和风险状态相关。这些数据揭示了肿瘤相关DC和原位激活在促进MM中抗原特异性T细胞浸润中的作用,并提供了关于恶性进化中肿瘤/免疫细胞空间变化的洞察。
关键词
适应性免疫;癌症免疫疗法;血液学;免疫学。
02
J Extracell Vesicles. 20230801
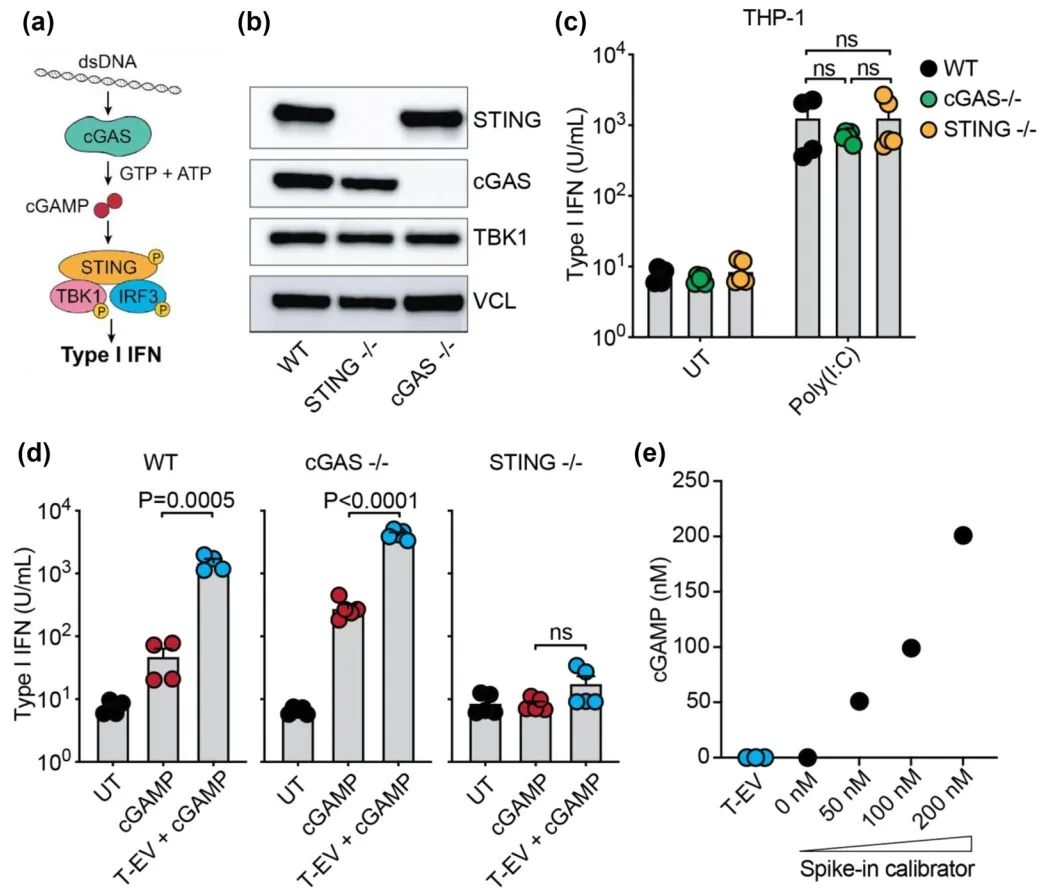
T细胞来源的细胞外囊泡通过激活巨噬细胞改善基于STING的癌症免疫疗法
J Extracell Vesicles. 2023 Aug;12(8):e12350.
doi: 10.1002/jev2.12350.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37525396/
内容简介
癌症中的一个关键现象是建立高度免疫抑制的肿瘤微环境(TME)。尽管免疫疗法取得了进展,其目的是诱导肿瘤识别从而实现肿瘤的消除,但适用此种治疗的大多数患者仍未能有效应答。有人认为肿瘤中的高免疫活性对于实现有效的免疫疗法反应是必要的,因此导致了触发炎症途径策略的探索。在这里,激活干扰素基因的刺激物(STING)信号通路被认为是一个有吸引力的目标,因为它能有效触发促炎细胞因子和I型、III型干扰素。然而,结合针对STING激动剂的免疫疗法在人体中并未产生持续的临床缓解。这表明有必要探索新的佐剂以提高先天免疫效能。在这里,我们展示了来自激活的CD4+ T细胞的细胞外囊泡(T-EVs)可以使巨噬细胞对STING激活敏感化,这是通过T-EVs上的IFNγ介导的。我们的工作支持了T-EVs可以通过重编程巨噬细胞为促炎表型,打破肿瘤中的免疫抑制环境,并促使巨噬细胞对STING激活产生强烈的免疫反应。
关键词
CDN疗法;IFNγ;STING;T细胞;癌症免疫学;细胞外囊泡;巨噬细胞。
03
Gut. 20230728
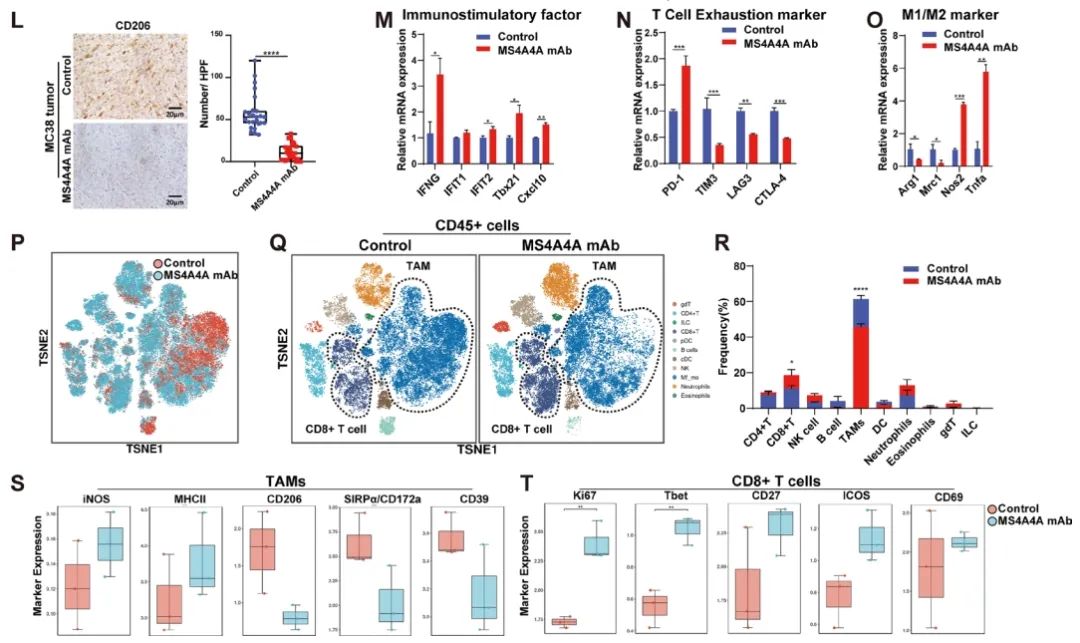
靶向肿瘤相关巨噬细胞上的MS4A4A以恢复CD8+ T细胞介导的抗肿瘤免疫
Gut. 2023 Jul 28;gutjnl-2022-329147.
doi: 10.1136/gutjnl-2022-329147.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37507218/
内容简介
目标:检查点免疫疗法释放了T细胞对肿瘤的控制潜力,但被免疫抑制性的髓样细胞抑制。跨膜蛋白MS4A4A在肿瘤相关巨噬细胞(TAMs)中选择性地高度表达。在这里,我们旨在揭示MS4A4A+ TAMs在调控肿瘤细胞免疫逃逸中的作用,并开发针对TAMs的新疗法以提高免疫检查点抑制剂(ICI)在结直肠癌中的疗效。
设计:使用小鼠皮下肿瘤或原位移植模型,评估MS4A4A阻断单独或与ICI治疗联合对肿瘤生长的抑制效果。通过流式细胞术和质谱细胞术评估MS4A4A阻断对肿瘤免疫微环境的影响。通过RNA测序和western blot分析进一步探索MS4A4A如何促进巨噬细胞M2极化的分子机制。
结果:MS4A4A在不同类型的肿瘤中由TAMs选择性表达,并与癌症患者的不良临床结果相关。体内抑制MS4A4A和抗MS4A4A单克隆抗体治疗都能抑制肿瘤生长并改善ICI疗法的效果。MS4A4A阻断治疗重塑了肿瘤免疫微环境,减少了M2-TAMs和耗竭T细胞的浸润,增加了效应CD8+ T细胞的浸润。抗MS4A4A与抗程序性细胞死亡蛋白1(PD-1)疗法在大的、治疗抵抗的肿瘤中仍然有效,并且在与放疗进一步结合时可以诱导肿瘤的完全缓解。从机制上讲,MS4A4A通过激活PI3K/AKT通路和JAK/STAT6通路促进巨噬细胞的M2极化。
结论:靶向MS4A4A可以增强ICI的效果,并代表了一种新的抗癌免疫疗法。
关键词
T淋巴细胞;结直肠癌;免疫疗法;巨噬细胞。
04
Cell Metab. 20230727
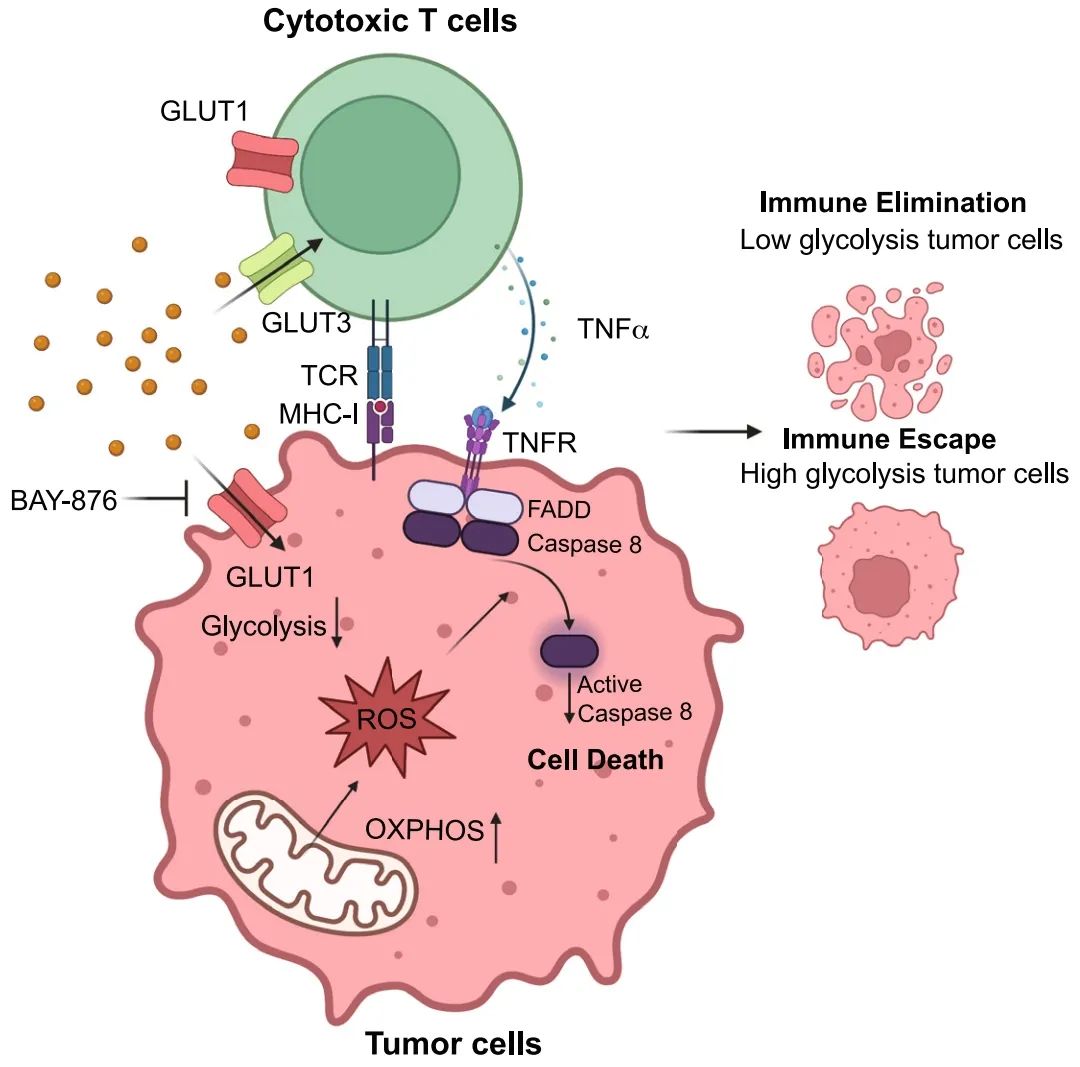
肿瘤有氧糖酵解促进免疫逃避,通过调节对T细胞介导的旁观者杀伤(TNF-α相关)的敏感性
Cell Metab. 2023 Jul 27;S1550-4131(23)00251-6.
doi: 10.1016/j.cmet.2023.07.001.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37506695/
内容简介
代谢重编程转向糖酵解是癌症的恶性标志。肿瘤糖酵解途径如何促进免疫逃避的分子机制仍待阐述。在这里,通过在与细胞毒性T细胞(CTLs)共培养的小鼠肿瘤细胞中进行全基因组CRISPR筛选,我们发现两种重要的糖酵解酶,Glut1(葡萄糖转运蛋白1)和Gpi1(葡萄糖-6-磷酸异构酶1)的缺乏导致CTLs对肿瘤细胞的杀伤增强。从机制上讲,Glut1的失活导致代谢重编程转向氧化磷酸化,产生过量的活性氧(ROS)。积累的ROS通过caspase-8和Fadd依赖的方式增强肿瘤坏死因子alpha(TNF-α)介导的肿瘤细胞死亡。Glut1的遗传和药理学失活使肿瘤对抗肿瘤免疫敏感,并通过TNF-α通路与抗PD-1疗法协同作用。肿瘤本身糖酵解与TNF-α诱导杀伤之间机制上的相互作用提供了增强抗肿瘤免疫的治疗新策略。
关键词
T细胞介导的杀伤;TNF-α;糖酵解;免疫逃避。
05
Cell. 20230802
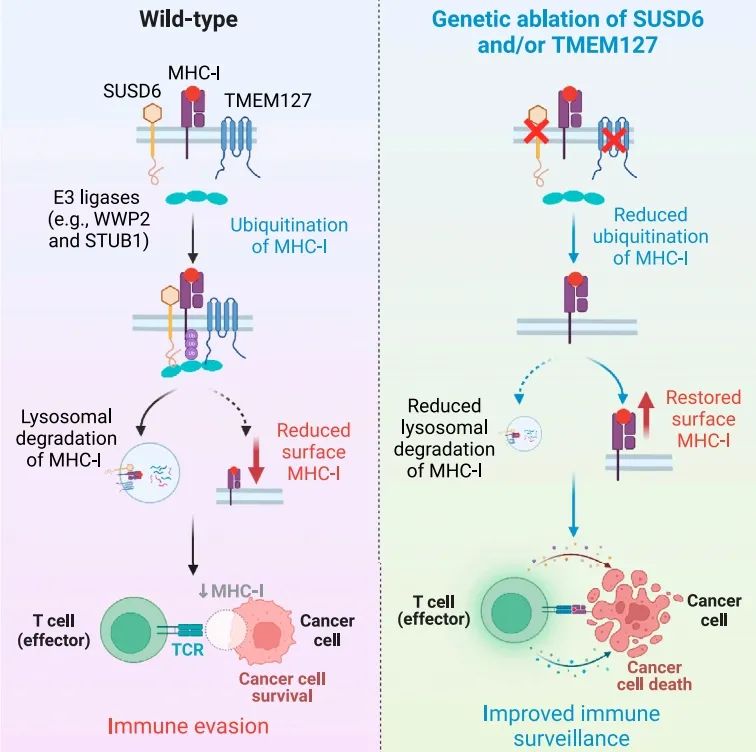
导致肿瘤免疫逃避的一种膜相关的MHC-I抑制轴
Cell. 2023 Aug 2;S0092-8674(23)00783-3.
doi: 10.1016/j.cell.2023.07.016.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37557169/
内容简介
免疫检查点阻断已经革命性地改变了癌症治疗,但一些癌症,如急性髓系白血病(AML),无法响应或产生抗药性。产生抗药性的一种可能模式是通过异常的主要组织兼容性复合体I类(MHC-I)抗原呈递逃避T细胞免疫。为了描绘这种抗药性机制,我们利用在AML中的特异性肽-MHC-I引导的CRISPR-Cas9筛选,确定了关键的MHC-I调控因子。排名最高的负调控因子是SUSD6,跨膜蛋白127(TMEM127),和E3泛素连接酶WWP2。SUSD6在AML和多种实体癌症中表达丰富,其消除增强了MHC-I的抗原呈递并以CD8+ T细胞依赖的方式减少了肿瘤生长。从机制上讲,SUSD6形成了与TMEM127和MHC-I的三分子复合物,这个复合物招募WWP2进行MHC-I的泛素化和溶酶体降解。结合SUSD6/TMEM127/WWP2的基因特征,这与癌症生存率呈负相关,我们的发现定义了一个膜相关的MHC-I抑制轴,这可能是白血病和实体癌症的潜在治疗靶点。
关键词
MHC-I;SUSD6;T细胞;TMEM127;WWP2;抗原呈递;癌症;免疫逃避;溶酶体降解;泛素化。
06
Cell. 20230809
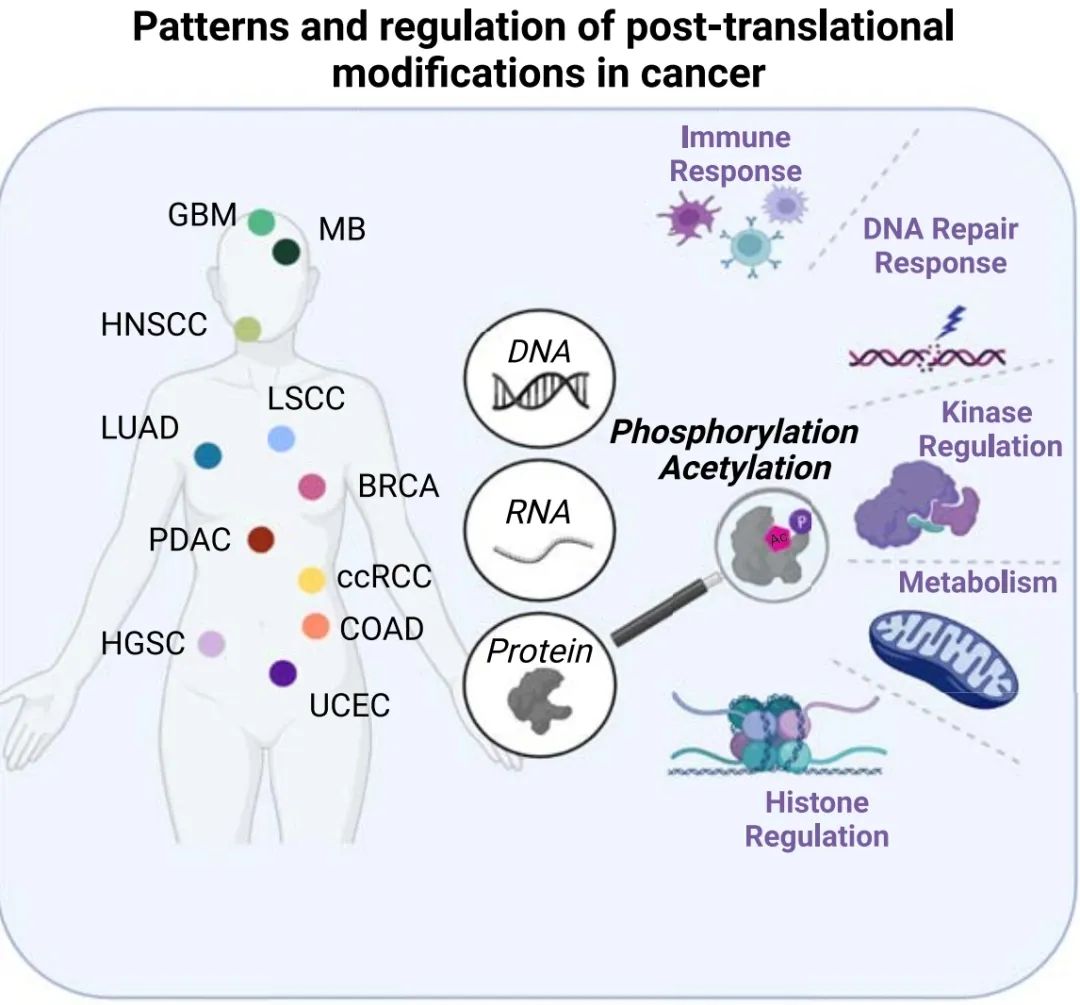
翻译后修饰的泛癌分析揭示了蛋白质调控的共有模式
Cell. 2023 Aug 9;S0092-8674(23)00781-X.
doi: 10.1016/j.cell.2023.07.013.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37582358/
内容简介
翻译后修饰(PTMs)在正常细胞和癌细胞的信号调控和生理过程中起着关键作用。质谱技术的进步使得对PTM水平的高通量、准确和灵敏的检测成为可能,以便更好地理解它们的角色、普遍性和交叉作用。在这里,我们分析了来自1,110名患者的最大的蛋白质组学数据集,该数据集包含了11种癌症类型的PTM剖面(其中10种来自国家癌症研究所的临床蛋白质组肿瘤分析联盟[CPTAC])。我们的研究揭示了癌症过程中与蛋白质乙酰化和磷酸化有关的泛癌改变模式。这些模式揭示了不同癌症类型的肿瘤子集,包括那些由磷酸化驱动的DNA修复调控失常、由乙酰化驱动的与免疫反应相关的代谢调控改变、通过乙酰化和磷酸化之间的交叉作用影响激酶特异性,以及通过翻译后修饰调节组蛋白调控。总的来说,这个资源揭示了PTMs所调控的丰富生物学特征,并提示了可能的新的治疗途径。
关键词
CPTAC;DNA损伤反应;基因组学;质谱学;代谢;泛癌;翻译后修饰;蛋白质组学;转录组学。
07
Sci Adv. 20230825
双调蛋白连接IL1RL1+调节性T细胞和癌症相关成纤维细胞以损害抗肿瘤免疫
Sci Adv. 2023 Aug 25;9(34):eadd7399.
doi: 10.1126/sciadv.add7399.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37611111/
内容简介
调节性T细胞(Treg)和癌症相关成纤维细胞(CAFs)共同促进肿瘤免疫耐受和肿瘤发生。在肿瘤微环境(TME)中驱动Treg细胞和CAF协同作用的分子机制仍然不清楚。白细胞介素33(IL-33)在肿瘤发生和组织修复过程中增强纤维化和IL1RL1+ Treg细胞的累积。我们证明了在Treg细胞中的IL1RL1信号通路大大抑制了IL-33和PD-1阻断的抗肿瘤活性。全肿瘤单细胞RNA测序(scRNA-seq)分析和阻断实验揭示了酰胺调素(AREG)-表皮生长因子受体(EGFR)轴介导了IL1RL1+ Treg细胞和CAFs之间的交互。我们进一步证明了AREG/EGFR轴使Treg细胞能够促进CAFs的增生纤维化和免疫抑制功能状态。此外,AREG单克隆抗体和IL-33共同抑制了肿瘤生长。我们的研究揭示了一个以前未知的通过AREG/EGFR介导的Treg/CAF联动,这个联动控制了成纤维细胞功能状态的转变,并且是癌症免疫疗法的关键障碍。
08
Sci Transl Med. 20230823
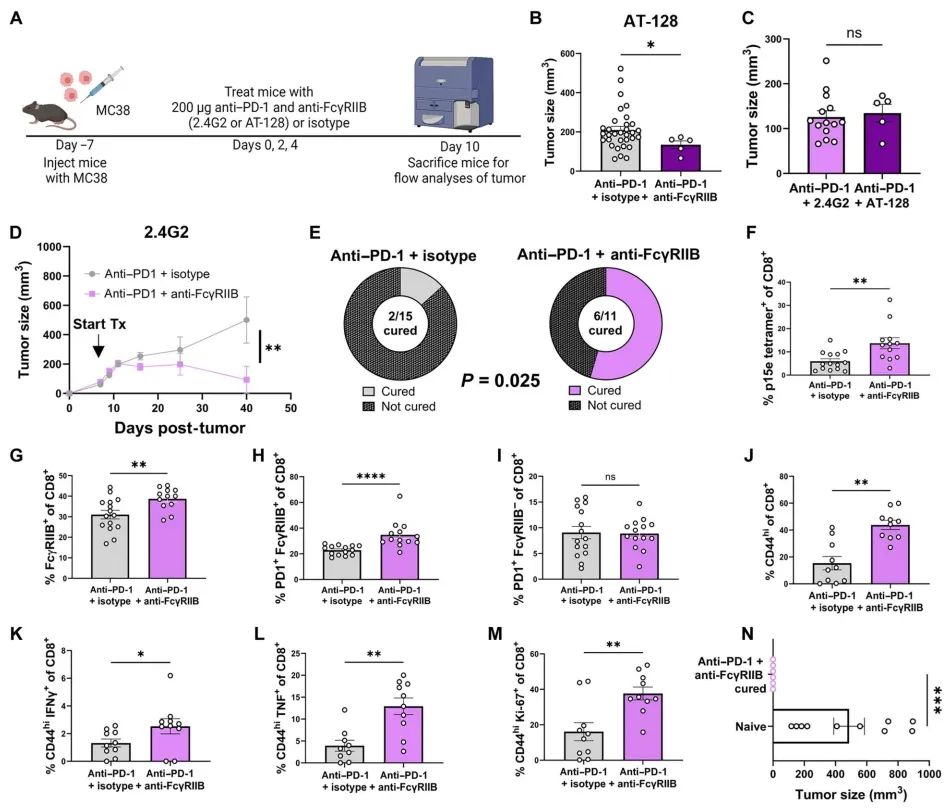
表达在CD8+ T细胞上的FcγRIIB限制了癌症中PD-1检查点阻断的反应性
Sci Transl Med. 2023 Aug 23;15(710):eadd1868.
doi: 10.1126/scitranslmed.add1868.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37611081/
内容简介
使用含Fc的单克隆抗体的检查点抑制已经成为增强抗肿瘤免疫的强大疗法。我们最近发现,在小鼠和人的肿瘤中,FcγRIIB是唯一的抑制性IgG-Fc受体,表达于高度分化的效应性CD8+ T细胞群,这提示CD8+ T细胞应答可能通过与T细胞表达的FcγRIIB结合的检查点抑制剂直接调节。在本研究中,我们发现尽管在基线时表现出强烈的增殖和细胞因子反应,人FcγRIIBpos CD8+ T细胞在体外对PD-1和CTLA-4检查点抑制的反应性低于FcγRIIBneg CD8+ T细胞。此外,纳武利尤单抗治疗后,黑色素瘤患者体内FcγRIIBpos CD8+ T细胞的频率降低。这种反应性的降低是FcγRIIB依赖性的,因为在肿瘤特异性CD8+ T细胞上的FcγRIIB条件性基因敲除改善了B16和LLC小鼠癌症模型对检查点阻断的反应。FcγRIIBpos CD8+ T细胞有限的反应性也依赖于检查点抑制剂的完整Fc区域,在使用Fc缺失的抗PD-1 F(ab)片段处理导致Fcγ riibpos CD8+ T细胞增殖增加,而不改变FcγRIIBneg CD8+ T细胞的反应。最后,在黑色素瘤、肺癌和结肠癌小鼠模型中,添加FcγRIIB阻断剂可提高PD-1检查点抑制的疗效。这些结果表明了FcγRIIB介导的CD8+ T细胞抑制的细胞自主机制,这限制了体内抗肿瘤免疫应答期间检查点抑制剂的疗效。
09
Clin Cancer Res. 20230823
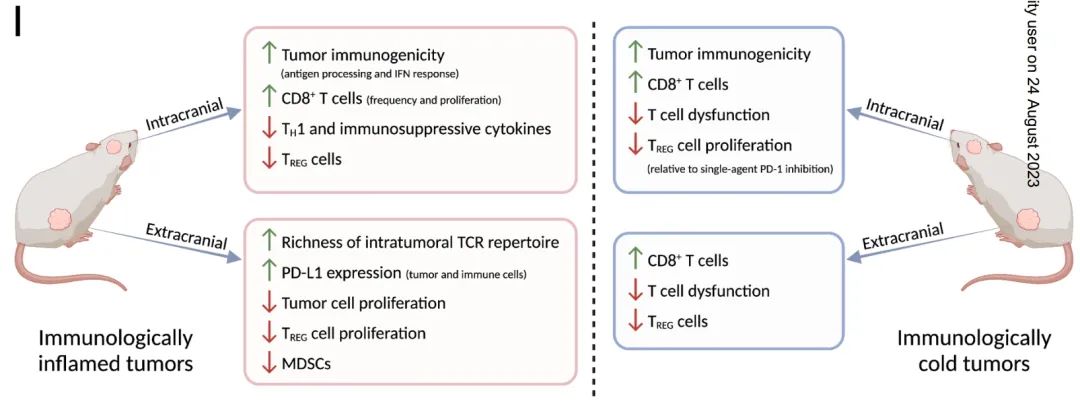
在脑转移的临床前模型中,抑制CDK4/6使颅内肿瘤对PD-1阻断敏感
Clin Cancer Res. 2023 Aug 23;CCR-23-0433.
doi: 10.1158/1078-0432.CCR-23-0433.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37611074/
内容简介
目的:脑转移的发病率高,且常对免疫检查点抑制剂耐药。我们评估了CDK4/6抑制剂(CDKi) abemaciclib是否可以使黑色素瘤和乳腺癌脑转移小鼠模型的颅内肿瘤对PD-1抑制增敏。
实验设计:使用同时携带颅内和颅外肿瘤的免疫正常小鼠脑转移模型在体内评估治疗反应。采用免疫荧光、多重免疫分析、高参数流式细胞术和T细胞受体分析评估颅内外肿瘤免疫微环境的治疗效果。在人源化免疫系统小鼠中用流式细胞术检测CDKi对人T细胞发育的影响。
结果:我们发现,abemaciclib联合PD-1抑制可降低小鼠的肿瘤负荷并改善总生存期。肿瘤免疫微环境因肿瘤解剖位置不同而不同,CDKi和PD-1抑制可以器官特异性方式改变肿瘤免疫微环境。abemaciclib联合抗PD-1治疗增加了颅内肿瘤中CD8+效应T细胞亚群的募集和扩增,清除了CD4+调节性T (TREG)细胞,并降低了免疫抑制性细胞因子的水平。在植入人类免疫系统的免疫缺陷小鼠中,abemaciclib治疗支持CD8+ T细胞的发育和维持并且可清除TREG细胞。
结论:我们的结果强调了颅内和颅外肿瘤的独特特性,并支持在脑转移患者中临床研究CDK4/6和PD-1抑制剂的联合应用。
10
J Clin Invest. 20230831
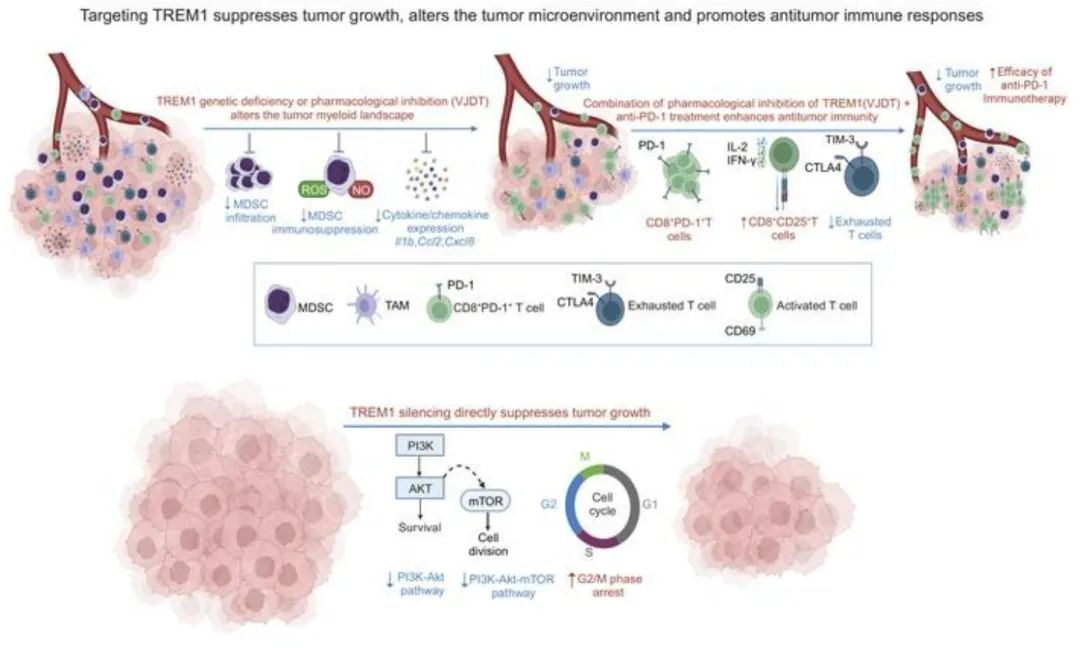
靶向TREM1抑制骨髓来源的抑制性细胞可有效增强抗肿瘤T细胞免疫并限制抗PD-1耐药
J Clin Invest. 2023 Aug 31;e167951.
doi: 10.1172/JCI167951.
PubMed:
https://pubmed.ncbi.nlm.nih.gov/37651197/
内容简介
髓系细胞上表达的受体TREM1在慢性炎症性疾病的发展和与大多数实体肿瘤相关的炎症肿瘤微环境(TME)中起着关键作用。我们研究了TREM1信号的缺失是否可以消除免疫抑制的TME并增强癌症免疫。为了探究TREM1在癌症中的治疗潜力,我们使用了Trem1缺乏的小鼠,并开发了一个新的小分子TREM1抑制剂,VJDT。我们证明了在基因或药理学上沉默TREM1显著延迟了小鼠黑色素瘤(B16F10)和纤维肉瘤(MCA205)模型的肿瘤生长。在TREM1缺陷时,通过单细胞RNA-seq结合功能测定揭示了骨髓来源的抑制性细胞(MDSCs)的免疫抑制能力减弱,伴随着细胞毒性CD8+ T细胞的扩增和PD-1表达增加。此外,抑制TREM1可通过限制MDSC频率和消除T细胞耗竭来增强抗PD-1治疗的抗肿瘤效应。在黑色素瘤患者来源的异种移植肿瘤中,VJDT治疗下调了涉及细胞增殖、迁移和生存的关键肿瘤发生信号通路。我们的工作强调了在癌细胞中内在表达的TREM1和在TME中外在表达的TREM1在癌症进展中的作用。因此,靶向TREM1来改变具有免疫抑制作用的TME并提高免疫检查点疗法的疗效是一种很有前景的癌症治疗方法。
关键词
癌症免疫治疗;细胞免疫反应;黑色素瘤;肿瘤学;治疗。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏