通过研究CD4+T细胞在抗肿瘤免疫中的作用,Kruse、Buzzai、Shridhar和Braun等揭示了一种…
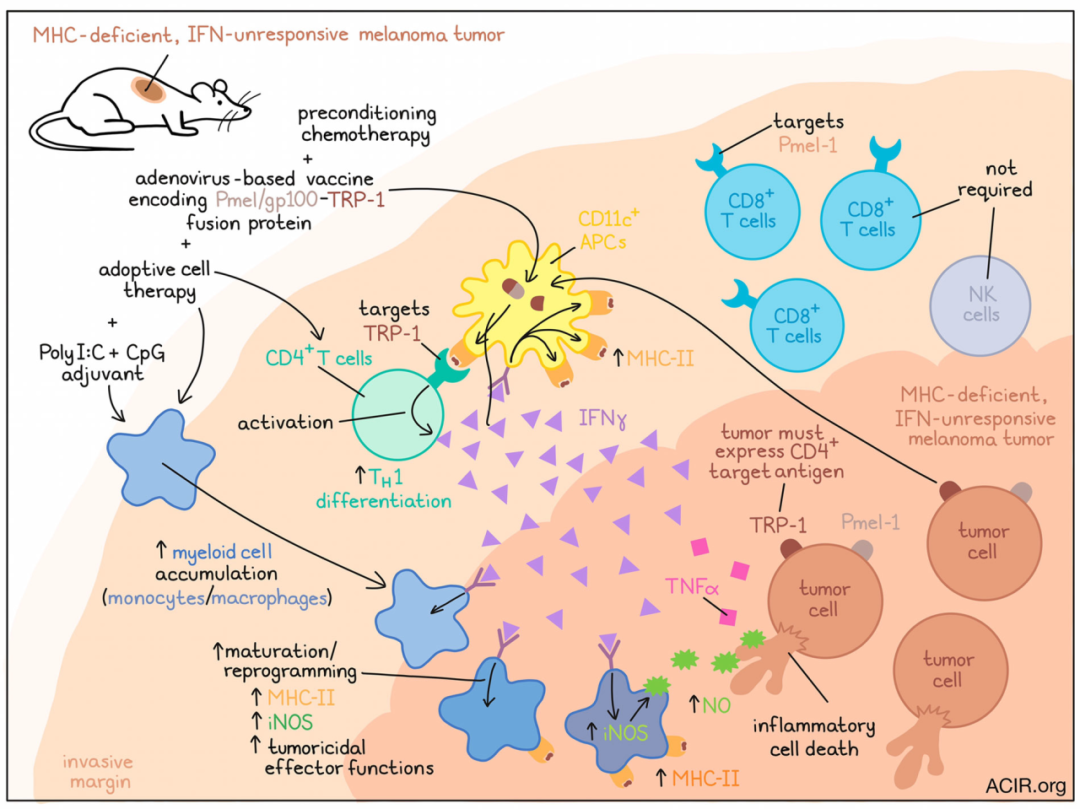
通过研究CD4+T细胞在抗肿瘤免疫中的作用,Kruse、Buzzai、Shridhar和Braun等揭示了一种机制,通过这种机制,少量CD4+T细胞可以消除MHC-缺陷、IFNγ-无反应的逃避CD8+T细胞靶向的肿瘤。他们最近发表在《Nature》杂志上的结果表明,与固有免疫刺激一致,CD4+T细胞聚集在肿瘤浸润的边缘,在那里,它们被MHC-II+CD11c+抗原呈递细胞激活,重编程肿瘤相关髓系细胞网络,并通过IFNγ、TNFα和iNOS支持诱导肿瘤细胞发生炎症性死亡。
首先,研究人员评估了来自黑色素瘤皮肤转移的样本和数据,发现MHC-I下调相对常见,并且与CD8+ T细胞缺乏和对免疫检查点阻断反应差相关。同时,MHC-II几乎总是局限于浸润边缘的基质细胞和抗原提呈免疫细胞,并且与浸润的CD8+T细胞相关。
为了直接研究CD4+和CD8+ T细胞在肿瘤中的行为,研究人员荧光标记了靶向TRP-1的CD4+T细胞和靶向Pmel-1的CD8+ T细胞。然后将这些细胞过继转移到化疗预处理的B16黑色素瘤荷瘤小鼠(内源性表达两种靶表位)体内,同时给这些小鼠注射编码Pmel/gp100-TRP-1融合蛋白的基于腺病毒的疫苗以及polyI:C和CpG佐剂。与CD8+ T细胞相比,CD4+T细胞扩增的效率要低得多,但同样具有根除已建立肿瘤的能力。化疗预处理和固有免疫刺激剂对于抗肿瘤疗效至关重要,有助于转移性和内源性CD4+T细胞向TH1表型分化,并防止Treg聚集。ACT(细胞过继转移)和固有免疫刺激各自独立地增加了髓系免疫浸润(主要由单核细胞和巨噬细胞组成),并且两者联合对单核细胞聚集的作用更强。
由于大多数人类黑色素瘤细胞不表达MHC-II,因此研究人员下一步研究了靶向 TRP-1的CD4+T细胞是否可以控制Ciita敲除((MHC-II缺陷)的HCmel12肿瘤。在体外实验中,靶向TRP-1的CD4+T细胞能够以抗原特异性方式直接对表达MHC-II的HCmel12细胞产生应答,但被负载HCmel12细胞裂解物的MHC-II树突状细胞间接激活的效率更高。在体内实验中,只要TRP-1表达,靶向TRP-1的CD4+T细胞就能清除MHC-II缺陷的肿瘤。虽然在TRP-1异质表达的MHC-II缺陷肿瘤中观察到一些旁观者杀伤,但Trp1-KO细胞的生长并不能完全得到控制。
考虑到HCmel12细胞在暴露于IFNs后仅表达MHC-I和MHC-II,研究人员生成了Jak1-KO HCmel12细胞,以干扰IFN信号传导和MHC表达,并在隔离状态下研究CD4+T细胞的影响。当NK细胞被清除,并且没有CD8+T细胞活性时,过继转移的靶向TRP-1的CD4+T细胞能单独清除已建立的肿瘤。在这一IFN无应答、MHC缺陷的模型中,靶向TRP-1的CD4 T细胞和Pmel-1 CD8+T细胞均显著增加了肿瘤中的髓系细胞数量,但与对照肿瘤相比,Jak1-KO肿瘤中增加的免疫细胞浸润不太明显。在OVA作为靶抗原的OT-I和OT-II模型中观察到了类似的结果。
接下来,Kruse、Buzzai、Shridhar和Braun等人提出,在肿瘤组织中,CD4效应T细胞可能被MHC-II抗原提呈细胞激活,而CD8+T细胞需要被肿瘤细胞上的MHC-I限制性抗原激活。这种效应通过对酪氨酸激酶敲除肿瘤的成像得到了证实。在对照Tyr-KO肿瘤中,侵袭边缘存在少量的CD4+T细胞,而侵袭边缘和肿瘤中心均有大量CD8+T细胞浸润。在MHC缺失的肿瘤中,侵袭边缘再次检测到低数量的CD4+T细胞和高数量的CD8+T细胞,但CD8+T细胞保持高度运动性,没有在肿瘤中心聚集。基于OVA的肿瘤免疫模型也观察到了类似的结果。
在携带标记抗原呈递细胞的小鼠中使用荧光标记的Tyr-KO HCmel12肿瘤细胞,研究人员能够观察到标记的CD4+T细胞在肿瘤浸润边界内停止并优先与标记的MHC-II抗原呈递细胞结合。位于CD4+T细胞附近的抗原提呈免疫细胞只上调MHC-II的表达,这与CD4+T细胞已被局部激活并分泌IFNγ的观点一致。在Trp1-KO肿瘤中或使用MHC-II阻断时,未观察到这些效应,提示它们是以抗原识别依赖的方式发生。
为了更好地理解如此少的CD4+T细胞如何能如此强地控制肿瘤生长,研究人员评估了来自未接受治疗的小鼠和接受CD4 ACT方案治疗的小鼠的CD11b+ Ly6G–肿瘤浸润单核吞噬细胞。这项评估表明治疗后IFN应答基因被强烈激活,并且流入的未成熟单核细胞转变为更多的IFN激活的单核/巨噬细胞状态,包括MHC-II抗原提呈、iNOS表达和肿瘤杀伤状态。此外,CD4+T细胞与固有免疫刺激物表现出协同作用,这一效应是由于CD4+T细胞产生IFNγ,从而促进了iNOS表达和单核细胞的肿瘤杀伤效应。
在研究TME中究竟哪些因素导致了肿瘤细胞死亡时,研究人员发现,iNOS对于Jak1-KO (IFN无应答,MHC缺陷)HCmel12肿瘤的抗肿瘤疗效至关重要,而对于Ciita-KO (IFN有应答,MHC-II缺陷)肿瘤则并非如此。与中性粒细胞相比,CCR2单核细胞在这一抗肿瘤作用中更重要,表明表达iNOS的单核细胞和巨噬细胞在其中发挥重要作用。研究了最近描述的由IFNγ、TNF和一氧化氮协同作用驱动的炎症细胞死亡模式,研究人员发现,在体外,一氧化氮供体SNAP有效地诱导了Ciita-KO (IFN应答)和Jak1-KO (IFN无应答)HCmel12细胞死亡。同时,IFNγ和TNF的联合作用仅足以对抗Ciita-KO (ifn -应答)的HCmel12细胞。在人类细胞中也观察到类似的结果,支持以下假设:在IFN反应性黑色素瘤中,IFNγ使细胞对TNF诱导的细胞死亡敏感,而在IFN无反应性黑色素瘤中,髓系细胞来源的一氧化氮促进了有效的炎症性细胞死亡。
总体而言,这些发现提示,在预处理和固有免疫刺激的支持下,相对较少的CD4+T细胞可消除MHC缺陷、IFNγ无反应的肿瘤,否则这些肿瘤就会逃避CD8 T细胞的检测。这一效应是基于肿瘤浸润边缘的抗原提呈细胞激活CD4+T细胞,继而产生IFNγ,导致单核/巨噬细胞重编程和炎症性细胞死亡。
本周,共同第一作者巴斯蒂安·克鲁斯和安东尼·布扎伊回答了我们的问题。
从左至右:通讯作者Thomas Tüting;共同第一作者安东尼·布扎伊和共同第一作者巴斯蒂安·克鲁斯
对你来说,这项研究最令人惊讶的发现是什么?
当我们观察到极少数CD4+T细胞可以控制对IFN无反应的肿瘤时,第一个令人惊讶的结果出现了,这些肿瘤抵抗了CD8+T细胞免疫。当时,我们并不了解CD4+T细胞如何如此有效地控制这些肿瘤,这导致我们发现CD4+T细胞的空间分布与CD8+T细胞有本质上的不同。这给我们带来了第二个惊人的发现,即CD4+T细胞并没有渗透到肿瘤组织中,而是通过与募集的髓系细胞相互作用,从外至内远程根除黑色素瘤。
这项研究前景如何?
我们希望进一步探索CD4+T细胞和固有免疫刺激物如何协同控制肿瘤,因为它们之间的相互作用如何使癌细胞对死亡敏感还不完全清楚。我们希望我们的研究结果能够使CD4+T细胞成为关注的焦点,从而进一步研究其在抗肿瘤免疫中的作用。我们相信利用CD4+T细胞的效应功能将在未来使癌症患者受益。
工作之外,你最近学到的最酷的事情是什么?
BK:我最近了解到,每个逆戟鲸都有自己的叫声来识别彼此。海洋生物学家认为这些独特的叫声就是它们的名字。
ACB:在牌局中,你应该只玩20%的起始手牌……这是我来之不易的教训。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab