1.摘要
越来越多的证据显示,恶性细胞的代谢重编促进了肿瘤的增长。这种代谢变化不仅为癌细胞的快速增殖提供能量,还帮助它们适应恶劣的生存环境,更重要的是,使得它们能够逃避身体的自然免疫及药物治疗的免疫攻击。本文综述了癌细胞如何通过内部和外部的代谢变化影响先天免疫和适应性免疫的功能,并探讨了这些变化对疾病进展的影响。此外,我们还讨论了针对这些代谢变化的治疗方法,以增强抗癌免疫反应的效果。
2.引言
肿瘤的恶性转化和进展伴随着多种代谢途径的变化,主要体现在以下三个方面。首先,一些关键的酶编码基因发生突变,如异柠檬酸脱氢酶1(IDH1)或IDH2,在胶质母细胞瘤和某些类型的白血病中常见,导致2-羟基戊二酸(2HG)的积累,从而促进肿瘤生长。其次,一些致癌蛋白或抑癌因子的遗传或表观遗传改变也直接影响代谢途径,例如KRAS的激活突变和肿瘤蛋白p53(TP53)的失活已证实会影响代谢。第三,癌细胞能够根据肿瘤微环境的变化调整自身的代谢,如在缺氧条件下通过低氧诱导因子1α(HIF1α)重编代谢。虽然这些情景概念上有所不同,但都为癌细胞创造了代谢上的脆弱点,可作为治疗的潜在靶点。
癌症代谢学的研究起源于一个世纪前,当德国生理学家奥托·H·瓦尔堡发现恶性细胞比正常细胞摄取更多的葡萄糖。研究表明,恶性转化和肿瘤进展涉及全细胞范围的代谢重编,这不仅仅局限于所谓的“瓦尔堡效应”,而是包括了氧化磷酸化、三羧酸循环、多种生物合成途径和全球性分解代谢途径,如自噬。这些变化不仅限于癌细胞,还涉及到肿瘤微环境,为癌细胞提供了必需的代谢底物,如核苷酸、脂质和氨基酸(Box 1)。此外,几乎所有癌细胞的代谢重编都赋予它们在不断变化的微环境中生存的能力,从而促进了肿瘤的多样化和演变。已有数据显示,癌细胞的代谢变化也能帮助它们逃避宿主免疫系统的监视和杀伤。
在本文中,我们将探讨核心代谢改变如何影响自然和药物驱动的抗癌免疫监视机制,并分析针对这些代谢变化的治疗策略,以增强抗癌免疫反应。我们将重点讨论DNA复制、转录和蛋白质合成等大分子代谢途径的潜在影响,虽然这些内容超出了本文的范围。同时,免疫细胞的代谢对肿瘤靶向免疫的作用将不在本文讨论范围内。
Box 1: 癌细胞代谢对肿瘤间质的影响
癌细胞与基质细胞(包括代谢活跃的癌症相关成纤维细胞[CAFs])密切互动,这在恶性病变中起重要作用。例如,卵巢癌细胞会向CAFs提供乳酸和谷氨酸,促进CAFs合成和释放谷氨酰胺,从而支持其自身增殖。类似的机制也在前列腺癌模型中观察到。胰腺癌细胞可以促进胰腺间质星状细胞的自噬反应,导致丙氨酸的局部释放,从而减少恶性细胞对葡萄糖和血清源营养物质的依赖。此外,胰腺癌细胞可以利用CAFs产生的胶原分解的脯氨酸,在营养有限的条件下生存。CAFs分泌的脯氨酸可能通过调节转化生长因子-β1信号通路诱导的氧化还原应激,促进癌细胞存活,这一点仍需进一步研究。其他基质细胞也通过代谢途径支持癌细胞增殖。例如,卵巢癌细胞中脂肪酸结合蛋白4(FABP4)的表达,似乎是促进癌症相关脂肪细胞脂肪分解的机制基础。脂肪酸分泌后被恶性细胞摄取,并通过脂肪酸氧化用于生物能量目的。总之,这些观察证明了肿瘤细胞和肿瘤微环境中的非转化成分(尤其是基质细胞)之间存在多重代谢交换。
3.葡萄糖、乳酸和三羧酸循环
为了满足其高能量需求,癌细胞通常会加速并多样化其能量代谢途径,包括通过糖酵解增加葡萄糖的摄取和改变三羧酸循环。这些代谢变化都会影响肿瘤的免疫反应(图1)。
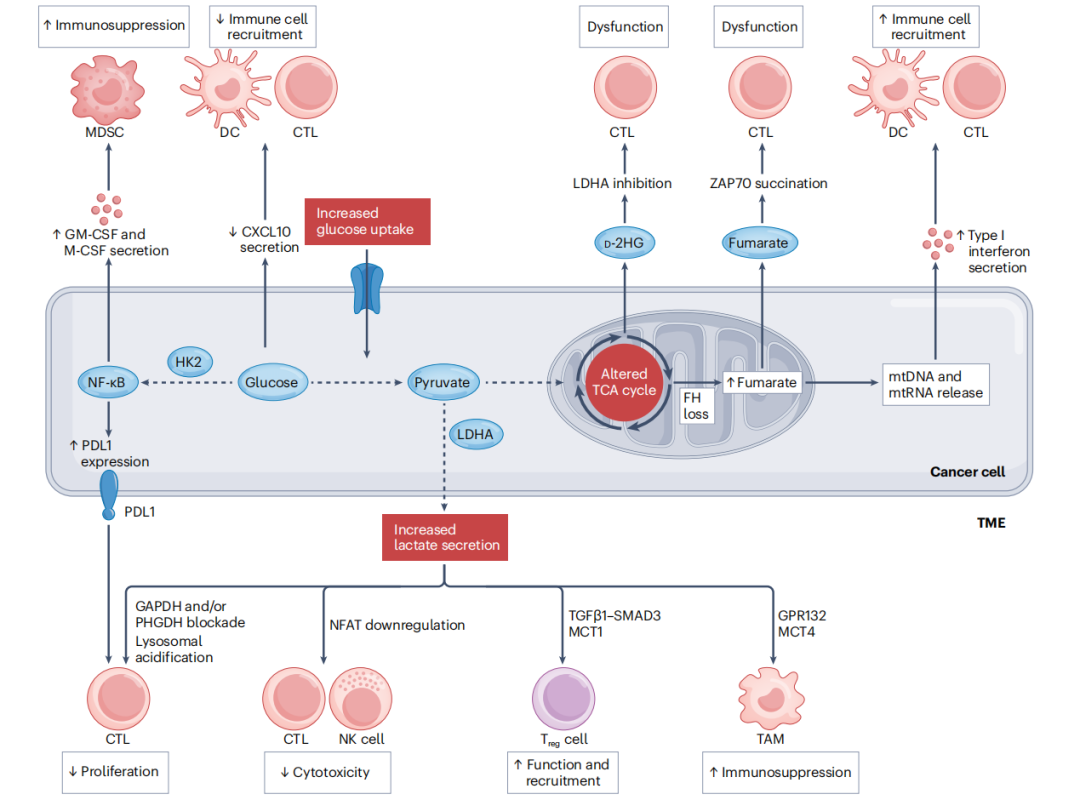
图1 葡萄糖、乳酸和三羧酸循环对抗癌免疫的影响
癌细胞的生物能量代谢特征包括增加葡萄糖摄取、分泌大量乳酸以及改变三羧酸循环(TCA循环),这些都对肿瘤免疫微环境(TME)产生重大影响。例如,癌细胞中糖酵解通量的增加与依赖己糖激酶2(HK2)的NF-κB激活和检查点分子PDL1的上调有关,还伴随着髓源性抑制细胞(MDSC)募集的细胞因子(如粒细胞-单核细胞集落刺激因子(GM-CSF)和巨噬细胞集落刺激因子(M-CSF))的分泌增加,以及减少了招募细胞毒性T淋巴细胞(CTL)和促炎趋化因子CXC-趋化因子配体10(CXCL10)的释放。研究表明,肿瘤微环境中的乳酸可以限制CTL和自然杀伤(NK)细胞的增殖和活化,同时促进调节性T细胞(Treg细胞)和肿瘤相关巨噬细胞(TAMs)的募集及其免疫抑制功能。TCA循环缺陷(如延胡索酸水合酶[FH]缺失)导致的线粒体改变与分泌直接抑制CTL的代谢中间产物(包括延胡索酸和d-2-羟基戊二酸[d-2HG])相关,并导致线粒体DNA(mtDNA)和线粒体RNA(mtRNA)的胞质积累,最终引发具有免疫刺激作用的I型干扰素的分泌。DC:树突状细胞;GAPDH:甘油醛3-磷酸脱氢酶;GPR132:G蛋白偶联受体132;LDHA:乳酸脱氢酶A;MCT:溶质载体;NFAT:活化T细胞核因子;PHGDH:磷酸甘油酸脱氢酶;TGFβ1:转化生长因子-β1;ZAP70:T细胞受体相关蛋白激酶70的ζ链
3.1 葡萄糖
癌细胞利用葡萄糖不仅用于能量生产——转化为丙酮酸后进入线粒体并进入三羧酸循环——还用于合成代谢,通过戊糖磷酸途径和丝氨酸合成途径。某些恶性肿瘤中,癌细胞与肿瘤微环境(TME)中的免疫细胞(特别是CD8+细胞毒性T淋巴细胞)竞争葡萄糖摄取。在肉瘤的免疫小鼠模型中,虽然免疫细胞通常比癌细胞消耗更多葡萄糖,但谷氨酸(一种可作为三羧酸循环替代底物的氨基酸)而非葡萄糖是TME中的限制性营养素。
黑色素瘤细胞中增加的糖酵解通量与趋化因子(如CXC-趋化因子配体10,CXCL10)表达降低相关,这些趋化因子涉及CTL的招募。此外,肿瘤细胞增加的葡萄糖摄取与在胶质母细胞瘤模型中通过己糖激酶2依赖的NF-κB介导的转录反应激活有关,最终导致表达PDL1(也称为CD274),这是T细胞上PD1的共抑制配体。增加的糖酵解通量也与三阴性乳腺癌细胞中过表达巨噬细胞集落刺激因子(M-CSF,也称为CSF1)和粒细胞-巨噬细胞集落刺激因子(GM-CSF,也称为CSF2)相关,导致TME向由骨髓源抑制细胞(MDSCs)主导的免疫抑制状态转变。在METABRIC公共数据集中,三阴性乳腺癌患者中乳酸脱氢酶A(LDHA)表达增加的患者发现与MDSCs相关的基因特征富集,而T细胞浸润相关的基因特征表现不足,这些患者的预后较差。
几种药物或遗传策略抑制糖酵解能够介导免疫刺激效果,并至少部分恢复肿瘤前临床模型中的免疫监视。例如,通过删除Glut1(也称为Slc2a1,编码质膜葡萄糖通道)或Gpi1(编码催化葡萄糖-6-磷酸和果糖-6-磷酸相互转化的异构酶)抑制小鼠Lewis肺癌细胞和小鼠胰腺癌(Panc02)细胞的糖酵解,已显示能增加恶性细胞对CTL的敏感性。这种免疫敏感性的增加是由于增加的氧化磷酸化(OXPHOS)和活性氧(ROS)以及对肿瘤坏死因子(TNF)驱动的细胞死亡的增加敏感性所致。是否Glut1或Gpi1的删除改变了癌细胞的抗原呈递仍需进一步研究。GLUT1水平和糖酵解的遗传标志与各种癌症患者肿瘤中T细胞浸润有限相关。肺癌或胰腺腺癌患者中,增加的糖酵解和降低的TNF介导信号的转录标记与较差的总生存率相关。这些发现突显了癌细胞糖酵解在抑制抗癌免疫中的临床相关性。
总之,癌细胞中的葡萄糖代谢可能对TME具有免疫抑制作用。值得注意的是,葡萄糖依赖的免疫抑制部分是由于乳酸分泌,这可能提供了比糖酵解更适合的治疗干预靶点。
3.2 乳酸
在大多数实体瘤中,乳酸含量丰富,除了提供营养功能外,还引发多种免疫抑制机制。例如,乳酸在黑色素瘤和结直肠癌(CRC)的小鼠模型中被发现可以抑制CTL介导的细胞毒性。其机制是通过限制丙酮酸羧化酶的活动,从而减少三羧酸循环中间体的补充,导致丙酮酸脱氢酶激活,降低琥珀酸分泌,最终减少琥珀酸受体1的促炎信号。
乳酸还通过阻断磷酸甘油醛脱氢酶(GAPDH)和磷酸甘油酸脱氢酶(PHGDH)的活性来抑制效应T细胞的增殖,这导致糖酵解中间体和丝氨酸水平下降,并通过促进溶酶体酸化干扰二酰基甘油依赖的蛋白激酶Cθ信号。与此观点一致,缺乏LDHA的小鼠B16黑色素瘤分泌较少的乳酸,其在免疫功能完整的小鼠中的生长速度比野生型慢。这些肿瘤的增强免疫控制与干扰素-γ(IFNγ)产生的CTL和自然杀伤细胞的增加浸润有关。然而,用小分子NCI-006抑制LDHA在缺少T细胞的无胸腺小鼠中也能抑制人类胰腺癌(MIA PaCa-2)异种移植物的生长,这表明NCI-006可能直接作用于恶性细胞或其他免疫细胞。
与上述发现相反,每日高剂量腹腔内注射乳酸能在免疫功能完整的小鼠中控制皮下建立的小鼠I3TC乳腺癌和MC38结直肠癌的生长。此外,皮下注射乳酸(而非葡萄糖)能在免疫功能完整的小鼠中引发CTL依赖的MC38肿瘤控制,这是由于增加了CD8+ T细胞的功能性。这些研究表明,乳酸对抗癌免疫的有害影响至少部分是由于乳酸依赖的TME酸化所致。
与效应T细胞相比,CD4+CD25+FOXP3+调节性T细胞(Treg细胞)对乳酸的抗增殖效应具有显著抵抗力,这部分是由于FOXP3引起的代谢重编,支持NADH氧化和OXPHOS。Treg细胞通过溶质载体MCT1(也称为SLC16A1)大量摄取乳酸,导致通过核因子激活的T细胞(NFATC1)依赖机制增加PD1表达。这在小鼠黑色素瘤和CRC模型中已被证实。在这些模型以及头颈部鳞状细胞癌模型中,MCT1表达对肿瘤内Treg细胞的免疫抑制功能至关重要,这部分归因于乳酸促进moesin乳酸化,从而通过SMAD3增强TGFβ1信号。此外,乳酸还通过组蛋白乳酸化在黑色素瘤和CRC模型中的髓系细胞中介导免疫抑制,促进肿瘤发展。
在糖酵解活跃的小鼠黑色素瘤、肝细胞癌和CRC中,PD1阻断能促进Treg细胞的免疫抑制活性,削弱治疗效果。然而,通过抑制LDHA降低乳酸水平可以逆转这种抗药性。在糖酵解活性较低的小鼠三阴性乳腺癌(TNBC)中,针对CTLA4的免疫检查点抑制剂(ICI)显示出良好的治疗效果,与肿瘤浸润的Treg细胞的不稳定和向分泌TNF和IFNγ的效应样状态转变相关。然而,细胞外乳酸与葡萄糖可用性对这些观察结果的具体贡献仍需进一步研究。
乳酸还影响肿瘤内的髓系细胞。例如,乳酸通过G蛋白偶联受体132(GPR132)向肿瘤相关巨噬细胞(TAM)发出信号,导致它们向免疫抑制的“M2样”表型重极化,增加肿瘤转移扩散。在TNBC患者中,GPR132水平与M2样TAM的遗传标志及疾病预后不良相关。在由Stk11缺失驱动的肺癌模型中,乳酸通过GPR81向TAM和CTL发出信号,尽管机制有所不同。
综上所述,乳酸在肿瘤内积累引起的免疫抑制效应主要源自于葡萄糖代谢的失调。
3.3 三羧酸循环(TCA循环)
三羧酸循环(TCA循环)在细胞代谢中扮演着关键角色,不仅提供NADH和琥珀酸作为氧化磷酸化(OXPHOS)的还原等价物,还调节许多具有代谢和信号功能的代谢物如乙酰辅酶A、柠檬酸、延胡索酸、α-酮戊二酸(α-KG)和琥珀酸。这些代谢中间体也在免疫调节中发挥直接或间接的作用。
缺乏TCA循环酶延胡索酸水合酶(FH)的小鼠B16黑色素瘤中,延胡索酸水平增加,这与糖酵解改变无关,导致T细胞受体相关蛋白激酶70(ZAP70)的ζ链非酶促琥珀酸化,进而引起急性T细胞功能障碍。此外,过表达FH的CD19嵌合抗原受体(CAR)T细胞在免疫缺陷小鼠中对人类CD19阳性白血病细胞表现出更好的治疗效果。在遗传性平滑肌瘤病和肾细胞癌的临床前模型中,FH的丧失破坏了线粒体网络,促进了通过sorting nexin 9(SNX9)依赖机制释放含有线粒体核酸的小囊泡。在这种情况下,线粒体DNA和RNA的释放激活了cGAS-STING和RIG-I途径,驱动I型干扰素的分泌,进而促进免疫细胞的招募,但也可能导致慢性炎症,支持肿瘤发展。
最近研究显示,OXPHOS中的电子流动限制了CTL对黑色素瘤细胞的识别。这种免疫抑制效应源自呼吸复合体II将琥珀酸转化为延胡索酸的能力,防止琥珀酸依赖的表观遗传机制上调MHC I类分子和其他抗原呈递机制。在小鼠TNBC模型中,TAM衍生的TGFβ1驱动的琥珀酸积累促进糖酵解,呈现免疫抑制表型。虽然琥珀酸的免疫调节效应尚未明确,但可能肿瘤特异性机制在糖酵解外起作用,例如TNBC中琥珀酸依赖的HIF1α积累(Box 2)。
2-羟基戊二酸(2HG)类似于TCA循环中间体α-KG,通过表观遗传机制具有致癌功能,特别是抑制α-KG依赖的双加氧酶、脯氨酸羟化酶和组蛋白去甲基化酶。2HG的d-对映体能被肿瘤浸润的淋巴细胞吸收,抑制其增殖和效应功能,包括IFNγ的分泌。这种免疫抑制效应源自d-2HG抑制LDHA,导致代谢转向OXPHOS,破坏NFATC1活性和多胺合成。
戊二酸是另一种抑制α-KG依赖的双加氧酶的代谢中间体,显示对T细胞功能有积极影响。戊二酸前体二乙基戊二酸的给药增强了T细胞对小鼠B16黑色素瘤和SKOV3卵巢癌细胞的细胞毒性,这是通过戊二酸化丙酮酸脱氢酶抑制OXPHOS并促进厌氧糖酵解实现的。
阻断乙酰辅酶A合成酶短链家族成员2(ACSS2)在乳腺癌细胞中将其转化为乙酸生产者,导致肿瘤微环境中乙酸积累。乙酸被肿瘤浸润的淋巴细胞吸收,对T细胞效应功能和增殖有积极影响,可能与通过FFAR2(GPR43)的乙酸信号有关。
异柠檬酸在多种细胞类型中具有免疫抑制效应。例如,异柠檬酸通过细胞渗透性前体激活NFE2L2(NRF2)抑制人类NSCLC A549细胞中STING1激活下游的I型干扰素反应。癌细胞来源的异柠檬酸对抗癌免疫反应的确切影响仍需研究。
总之,癌细胞代谢变化,包括葡萄糖、乳酸和TCA循环的变化,已被证明会扰乱肿瘤微环境,产生负面的免疫监视效应。
Box 2: 微环境缺氧与抗肿瘤免疫
实体瘤的一个显著特征是某些区域的氧分压低于正常生理值。恶性细胞通过多种机制适应这些缺氧条件,这些机制通常由转录调节因子缺氧诱导因子1α (HIF1α)调控。HIF1α引发的主要代谢转变是葡萄糖代谢从氧化磷酸化转向无氧糖酵解。这与大量乳酸的分泌有关,而乳酸具有显著的免疫抑制作用。此外,HIF1α促进血管内皮生长因子A (VEGF-A)的上调,除了促进新生血管生成外,还支持CD4+CD25+FOXP3+调节性T细胞的聚集和免疫抑制活性。此外,HIF1α通过上调外核苷酸酶CD39和CD73的表达,增加细胞外ATP的降解,并促进腺苷A2a受体(ADORA2A)和ADORA2B的表达,进而促进腺苷信号传导,从而增强免疫抑制性核苷酸代谢。值得注意的是,缺氧还通过其他途径诱导免疫抑制,包括激活肿瘤浸润T细胞中的CD39依赖的耗竭程序、促进肿瘤相关巨噬细胞向“M2型”状态转变,以及减少肿瘤靶向γδ T细胞。因此,缺氧是肿瘤微环境中免疫抑制的主要驱动因素。
4.脂质代谢
癌细胞的增殖显著依赖于脂质代谢的增强,不仅为脂肪酸氧化(FAO)驱动的氧化磷酸化(OXPHOS)提供额外能源,还作为细胞膜和其他脂质合成的来源。研究表明,与癌症相关的FAO和脂肪酸合成的改变会影响抗肿瘤免疫反应(图2)。
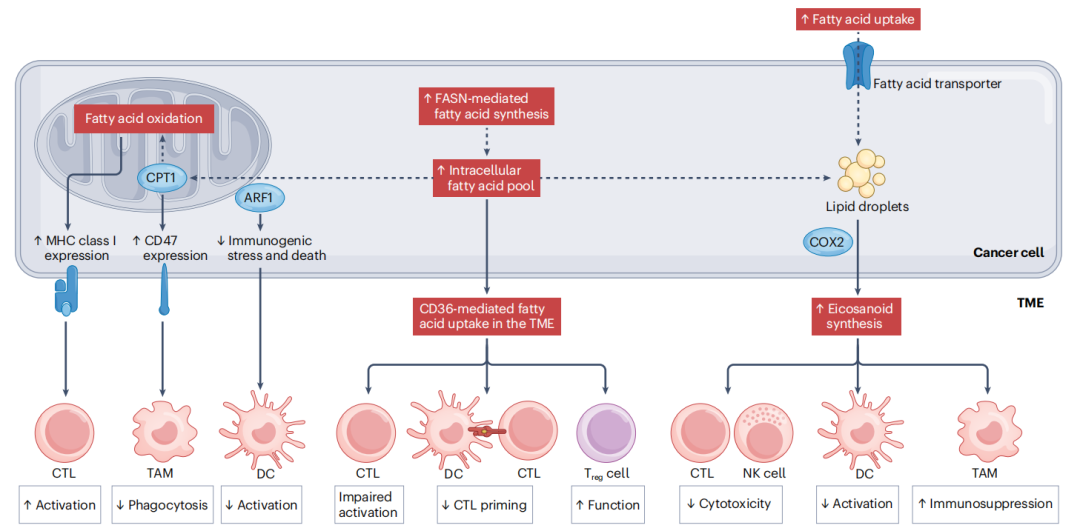
图2 脂肪酸和类花生酸代谢对抗癌免疫的影响。癌细胞通常从肿瘤微环境(TME)中摄取更多的脂肪酸,并通过脂肪酸合成酶(FASN)增加内源性脂肪酸的合成。这会导致多种免疫调节效应。增加癌细胞表面MHC I类分子的暴露可以增强细胞毒性T淋巴细胞(CTL)的识别能力,而表面CD47的增加则限制了髓系细胞的吞噬作用,通过ADP核糖基化因子1(ARF1)抑制免疫原性细胞死亡途径可以减少树突状细胞(DC)的活化。此外,TME中高水平的脂肪酸被免疫细胞通过CD36依赖的方式摄取,对CTL和DC具有直接的免疫抑制作用,同时增加了调节性T细胞(Treg细胞)介导的免疫抑制。最后,癌细胞可以将储存为脂滴的脂肪酸转化为具有免疫抑制作用的类花生酸,如前列腺素E2(PGE2)。COX2:环氧化酶2;CPT1:肉碱棕榈酰转移酶1;NK:自然杀伤细胞;TAM:肿瘤相关巨噬细胞
4.1 脂肪酸氧化(FAO)
FAO通过将长链脂肪酸分解为乙酰辅酶A,为三羧酸循环(TCA循环)提供底物以驱动OXPHOS。多种癌症类型(如胶质母细胞瘤,GBM)表现出FAO率的增加,支持了疾病的进展。在GBM中,多种与FAO相关的酶如肉毒碱棕榈酰转移酶1A(CPT1A)、CPT2和酰辅酶A脱氢酶家族成员9(ACAD9)的上调,伴随着细胞膜上“不吃我”信号CD47的增加,抑制了髓系细胞的吞噬作用并增强了放射抗性。这反映了FAO衍生的乙酰辅酶A驱动的抗凋亡NF-κB信号。联合使用放疗、CPT1抑制剂和CD47阻断剂在GBM临床前模型中显示出比单独放疗更好的肿瘤控制效果。
乙酰辅酶A也是自噬的强效抑制剂,自噬具有强大的免疫调节活性,可能在FAO的免疫效应中发挥作用(Box 3)。CPT1A的表达还通过促进抗凋亡信号,使癌细胞对CTL衍生的IFNγ具有抗性,至少在小鼠黑色素瘤B16和小鼠前列腺癌RM1细胞中是如此。
与FAO的免疫抑制效应相矛盾,有报道称,从小鼠黑色素瘤细胞中删除与FAO相关的基因乙酰辅酶A乙酰转移酶1(Acat1)会损害免疫识别和肿瘤清除,部分原因是癌细胞表面MHC I类分子表达的减少以及TME中T细胞活化的减少。这可能反映了ACAT1在胆固醇酯化中的作用,可能影响与MHC分子相关的细胞膜脂筏。尽管这些数据存在矛盾,蛋白质组学研究表明,脂质代谢和OXPHOS在对PD1免疫检查点抑制剂反应良好的晚期黑色素瘤患者中被富集。这些观察是否适用于其他肿瘤类型还有待进一步研究。
由ADP核糖基化因子1(ARF1)介导的FAO上游的脂质动员与癌干细胞的强大免疫逃逸属性相关。在遗传工程的结直肠癌模型中删除Arf1显著减慢了疾病的发病和进展,激活了免疫原性压力和癌干细胞区域的细胞死亡途径,进而激活了树突状细胞(DC)依赖的抗肿瘤免疫反应。
这些研究表明,FAO在癌细胞中对肿瘤微环境(TME)的免疫环境结构和癌症对免疫治疗的敏感性有重要影响。脂质代谢的改变不仅影响癌细胞的能量供应和合成需求,还显著调节肿瘤免疫反应和治疗效果。
Box 3: 癌细胞的自噬反应和抗肿瘤免疫
自噬是一种依赖溶酶体的分解代谢过程,用于处理潜在的细胞毒性和/或功能障碍的细胞质成分(如受损的线粒体)。自噬在所有有核细胞中起着重要的稳态和代谢功能,从而支持许多免疫细胞的分化和功能。此外,研究表明,恶性细胞中的自然和治疗诱导的自噬反应可以通过多种情境依赖机制影响靶向肿瘤的免疫反应。一方面,免疫原性化疗驱动的自噬反应被证明是死亡细胞最佳释放ATP所需,这协调了树突状细胞的募集和活化,并最终促进CD8+细胞毒性T淋巴细胞(CTL)依赖的抗癌免疫。另一方面,自噬也被报道具有强大的免疫抑制作用,包括抑制I型干扰素反应,例如在恶性细胞中由放疗诱发,或在高突变负荷的肿瘤中自发驱动,导致调节性T细胞优先浸润肿瘤并伴随CTL耗竭。此外,自噬还可以抑制癌细胞表面MHC I类分子的暴露,降低其抗原性,以及降解自然杀伤细胞产生的颗粒酶B,从而降低对免疫效应细胞的敏感性。因此,恶性细胞的自噬反应是抗癌免疫各方面的核心调节因素。然而,自噬调节剂的开发面临多项尚未解决的挑战。
4.2 脂质合成
脂肪酸合酶(FASN)是新生脂质生物合成的限速酶,其表达水平通常与癌症的晚期阶段和转移性扩散相关。在卵巢癌患者中,高水平的FASN与肿瘤中T细胞浸润的减少相关。这不仅是由于CD36依赖的T细胞对肿瘤微环境中积累的脂肪酸的直接吸收导致的T细胞抑制,还包括由于脂质驱动的T细胞交叉呈递缺陷由树突状细胞(DCs)介导,以及促进调节性T细胞(Treg)功能。与CD36介导的脂肪酸吸收的免疫抑制作用相符,肿瘤中表达CD36的CD8+ T细胞浸润与接受免疫原性化疗的非小细胞肺癌(NSCLC)患者的不良疾病预后相关。
4.3 花生四烯酸合成
增加的FASN活性还促进了与前列腺素内过氧化物合酶2(PTGS2;更广为人知的名称是环氧化酶2(COX2))相关的细胞内脂滴的积累,这是合成包括前列腺素E2(PGE2)在内的花生四烯酸的关键酶。PGE2对恶性细胞具有直接的促分裂作用,同时具有多种免疫抑制效果。这些包括由于前列腺素E受体2(PTGER2)和PTGER4信号传导及细胞内环磷酸腺苷水平的增加引起的树突状细胞功能障碍,抑制自然杀伤细胞的细胞毒性和分泌活性(这也影响到交叉呈递抗原给T细胞所需的1型常规DCs的招募),以及通过NF-κB介导的PD1上调导致的T细胞抑制,这一效应被PGE2上调髓系细胞上的PDL1表达的能力加剧。
PGE2还在髓系细胞上外膜核苷酸酶CD73的上调方面与缺氧的免疫抑制作用相似,这有助于免疫抑制的核苷酸代谢效应(Box 2)。有趣的是,磷脂酰胆碱转运蛋白MFSD2A已被显示为在人类和小鼠胃癌细胞中作为内源性COX2抑制剂,减少PGE2和免疫抑制细胞因子TGFβ1的生产和释放。在这种情况下,恶性细胞过表达MFSD2A已被显示为绕过PD1阻断的抗性,并与TME中改善的CD8+ CTL反应相关。
这些观察突出显示了脂肪酸代谢与肿瘤微环境中免疫细胞功能之间的复杂相互作用。更好地理解这些机制将为开发新的治疗策略提供宝贵的见解,以提高免疫治疗的效果。
5.其他代谢途径
在恶性转化过程中,其他代谢途径的变化也会影响抗癌免疫监视。这些途径包括(但不限于)核苷酸和各种氨基酸的代谢(图3)。
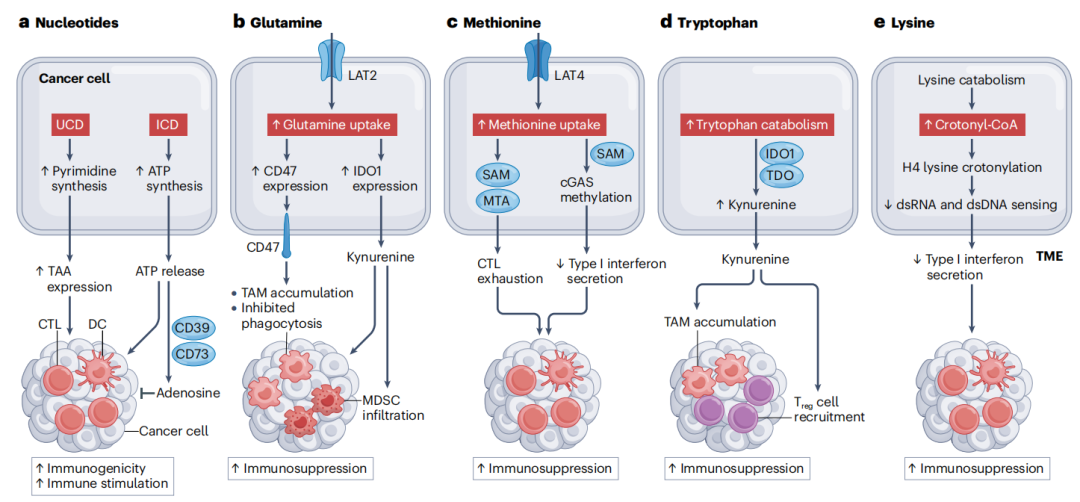
图3 核苷酸和氨基酸代谢对抗癌免疫的影响。a. 尿素循环失调。尿素循环失调(UCD)通过促进肿瘤相关抗原(TAA)的表达,提高了癌细胞的免疫原性。在免疫原性细胞死亡(ICD)过程中,释放的ATP对髓系细胞具有强大的趋化和免疫刺激作用。然而,这些作用可以被外核苷酸酶CD39和CD73将细胞外ATP转化为免疫抑制性腺苷的过程所抵消。b. 谷氨酰胺代谢。癌细胞通过LAT2增加对谷氨酰胺的摄取,这有利于免疫抑制性肿瘤相关巨噬细胞(TAMs)和髓源性抑制细胞(MDSCs)的积累,因为它们上调了CD47(可抑制吞噬作用)和吲哚胺2,3-双加氧酶1(IDO1),从而导致免疫抑制性犬尿氨酸的积累。c. 蛋氨酸代谢。肿瘤细胞通过LAT4摄取蛋氨酸,产生5-甲基硫腺苷(MTA)和S-腺苷蛋氨酸(SAM),促进细胞毒性T淋巴细胞(CTL)耗竭。蛋氨酸还通过甲基化环GMP-AMP合酶(cGAS)抑制I型干扰素的分泌。d. 色氨酸代谢。在癌细胞和髓系细胞中,色氨酸通过IDO1和色氨酸2,3-双加氧酶(TDO)降解,产生包括犬尿氨酸在内的免疫抑制性代谢产物,促进免疫抑制性巨噬细胞表型和调节性T细胞(Treg细胞)的募集。e. 赖氨酸代谢。赖氨酸被证明可以抑制恶性细胞中由双链RNA(dsRNA)和双链DNA(dsDNA)诱导的组蛋白H4赖氨酸巴氏化,从而减少I型干扰素的产生。DC:树突状细胞;TME:肿瘤微环境
5.1 核苷酸
与正常细胞相比,癌细胞的核苷酸合成增加,这对抗癌免疫有显著影响。例如,癌细胞中尿素循环酶的改变导致尿素循环失调(UCD),将氮流转向碳酰磷酸合成酶2、天冬氨酸转氨酶和二氢乳清酸脱氢酶(CAD),导致嘧啶合成过剩。这样的改变促进了一种独特的基因组特征,其特征是嘌呤到嘧啶的易位,并与黑色素瘤患者对免疫检查点抑制剂(ICI)敏感性增加相关。
在结直肠癌(CRC)临床前模型中,通过耗尽精氨酸琥珀酸合成酶1引发的UCD也发现了类似的结果。此外,处于压力状态和死亡的恶性细胞释放的核苷酸对肿瘤微环境(TME)的免疫构造和免疫系统对癌细胞死亡的反应产生了重大影响。例如,髓系细胞(包括树突细胞及其前体)可以通过嘌呤受体P2Y2(P2RY2)检测到细胞外ATP,促进趋化作用,吸引髓系细胞靠近死亡细胞。ATP还可以与P2RX7结合,通过炎症体信号传导和IL-1β分泌促进DC激活。
ATP的这种免疫刺激效应被细胞外核苷酸酶CD39和CD73的活性降解,二者共同促进腺苷的生成,腺苷是一种强效的免疫抑制分子。因此,肿瘤内CD39和CD73的水平(在不同肿瘤和同一肿瘤的不同区域表现出显著差异)决定了细胞外ATP免疫刺激(CD39和CD73表达低)与免疫抑制(CD39和CD73表达高)的平衡。
这些研究表明,癌细胞中的核苷酸代谢变化可能成为实现免疫治疗效果的新靶点。目前,这些方法正在临床试验中进行研究,并显示出有希望的结果(见下文)。
5.2 谷氨酰胺
肿瘤微环境(TME)中的谷氨酰胺是快速增殖的癌细胞和免疫细胞的重要能量和中间代谢物来源。大多数癌细胞消耗谷氨酰胺的速率比葡萄糖更高,并且这种利用至少在一定程度上不依赖癌基因。具有高谷氨酰胺代谢特征的人类基底细胞样乳腺癌似乎很少发生免疫浸润,与疾病的不良结局相关。这表明这种代谢适应具有免疫抑制功能。因此,从小鼠三阴性乳腺癌(TNBC)细胞中删除谷氨酰胺酶(Gls,编码谷氨酰胺分解代谢的第一个酶)被证明可以通过T细胞依赖性机制促进体内肿瘤控制。
通过在TME中优先激活的前药(JHU083)药理抑制GLS,可以抑制癌细胞中的氧化和糖酵解代谢,同时促进CTLs中的氧化磷酸化(OXPHOS),从而诱导持久活化的表型。这在携带MC38结直肠癌的小鼠中驱动了强大的抗癌反应。这些发现表明,有效靶向癌细胞中的谷氨酰胺代谢,同时保护肿瘤内CTLs的治疗策略具有较高潜力。
谷氨酰胺代谢还影响髓系细胞的募集和活化。例如,在TNBC的临床前模型中,药物抑制GLS可以限制髓系抑制细胞(MDSCs)在肿瘤中的浸润,并使肿瘤相关巨噬细胞(TAMs)向免疫刺激的M1样特征转变。这部分是由于恶性细胞和免疫细胞中吲哚胺2,3-双加氧酶1(IDO1)的下调,导致免疫抑制性代谢产物犬尿氨酸显著减少。
此外,在黑色素瘤和结直肠癌的小鼠模型中,恶性细胞通过溶质载体SLC38A2与1型常规树突状细胞竞争肿瘤内的谷氨酰胺可用性。这表明肿瘤细胞上的SLC38A2是新型免疫抗癌药物的潜在靶点。在临床前骨肉瘤模型中,癌细胞通过LAT2(也称为SLC7A8)增加的谷氨酰胺摄取与CD47的上调相关,导致吞噬作用受到抑制并加速肿瘤进展。
综上所述,这些发现展示了谷氨酰胺代谢在癌症和免疫细胞中的多种免疫调节功能。
5.3 甲硫氨酸
甲硫氨酸(蛋氨酸)是一种必需氨基酸,除了促进蛋白质合成外,还参与酶促甲基化反应。在小鼠和人类肝细胞癌模型中,甲硫氨酸再循环酶及其产物(包括5-甲基硫腺苷和S-腺苷甲硫氨酸[SAM])水平的增加与T细胞耗竭相关。在这种情况下,敲除甲硫氨酸腺苷转移酶2A(Mat2a,该酶在SAM合成中起关键作用)恢复了体内T细胞活化和肝细胞癌的控制。类似地,甲硫氨酸已被证明以甲基化依赖性方式损害cGAS活性。
值得注意的是,癌细胞通常表达高水平的甲硫氨酸转运体LAT4(也称为SLC43A2),从而与T细胞竞争这种必需氨基酸。这导致T细胞中二甲基化组蛋白H3赖氨酸79(H3K79me2)的丧失,减少信号转导和转录激活因子5A(STAT5A)信号传导,并抑制T细胞功能。在携带结直肠癌的小鼠中,抑制LAT4和补充甲硫氨酸均可克服这一缺陷并恢复抗癌免疫。肿瘤特异性LAT4抑制联合cGAS-STING1激活(通过携带靶向slc43a2的CRISPR-Cas9构建物和Zn2+离子的双金属纳米平台实现)在临床前TNBC模型中表现出有前景的免疫治疗效果。
这些例子表明,LAT4是开发新型免疫刺激剂的潜在靶点。在这种情况下,我们必须设想有针对性的方法,能够从癌细胞中选择性地消耗甲硫氨酸,而不影响免疫细胞的甲硫氨酸摄取,因为免疫细胞的抗癌功能也依赖于甲硫氨酸的摄取。
5.4 色氨酸
由酶IDO1和色氨酸2,3-双加氧酶(TDO)启动的色氨酸分解代谢引起了相当大的关注,作为开发新型免疫治疗策略的潜在靶点。在一些恶性细胞和耐受性树突状细胞(DCs)中,IDO1的过度活化导致了广泛的免疫抑制作用,这主要是由于犬尿氨酸的积累。犬尿氨酸能有效抑制T细胞并促进调节性T细胞(Treg)的分化。
尽管色氨酸是一种必需氨基酸,但在肿瘤微环境(TME)中的浓度并未低于限制阈值,这表明色氨酸缺乏并不是IDO1驱动的免疫抑制的主要机制。IDO1通路的其他免疫抑制产物包括喹啉酸,已被证明在胶质母细胞瘤(GBM)中通过促进FOXO1下游的M2型肿瘤相关巨噬细胞(TAM)极化和过氧化物酶体增殖物激活受体-γ信号通路起作用。
5.5 赖氨酸
胶质母细胞瘤干细胞已被证明能够重编程赖氨酸分解代谢,导致巴豆酰辅酶A在细胞内积累,进而引起组蛋白H4赖氨酸的巴豆化。在这种情况下,抑制赖氨酸的巴豆化可增强由双链RNA(dsRNA)和双链DNA(dsDNA)诱导的I型干扰素信号传导,最终恢复肿瘤中的CD8+ T细胞浸润,并抑制疾病进展。这些研究表明,赖氨酸代谢可能作为开发新型免疫疗法的潜在靶点,但目前尚不清楚这一机制是否在GBM以外的其他癌症类型中起作用。
6.靶向肿瘤细胞代谢
针对癌细胞代谢的小分子和单克隆抗体已经开发了几十年,目前有多种药物正在临床评估。越来越多的数据显示,这些药物中至少有一部分可以有效恢复癌症的免疫监视,并提高肿瘤对现有抗癌疗法的敏感性。这些疗法不仅包括免疫疗法,还包括免疫原性化疗和一些靶向抗癌药物(表1)。目前还有几种饮食干预措施正在研究中,旨在通过改变癌细胞代谢来增强抗癌免疫。
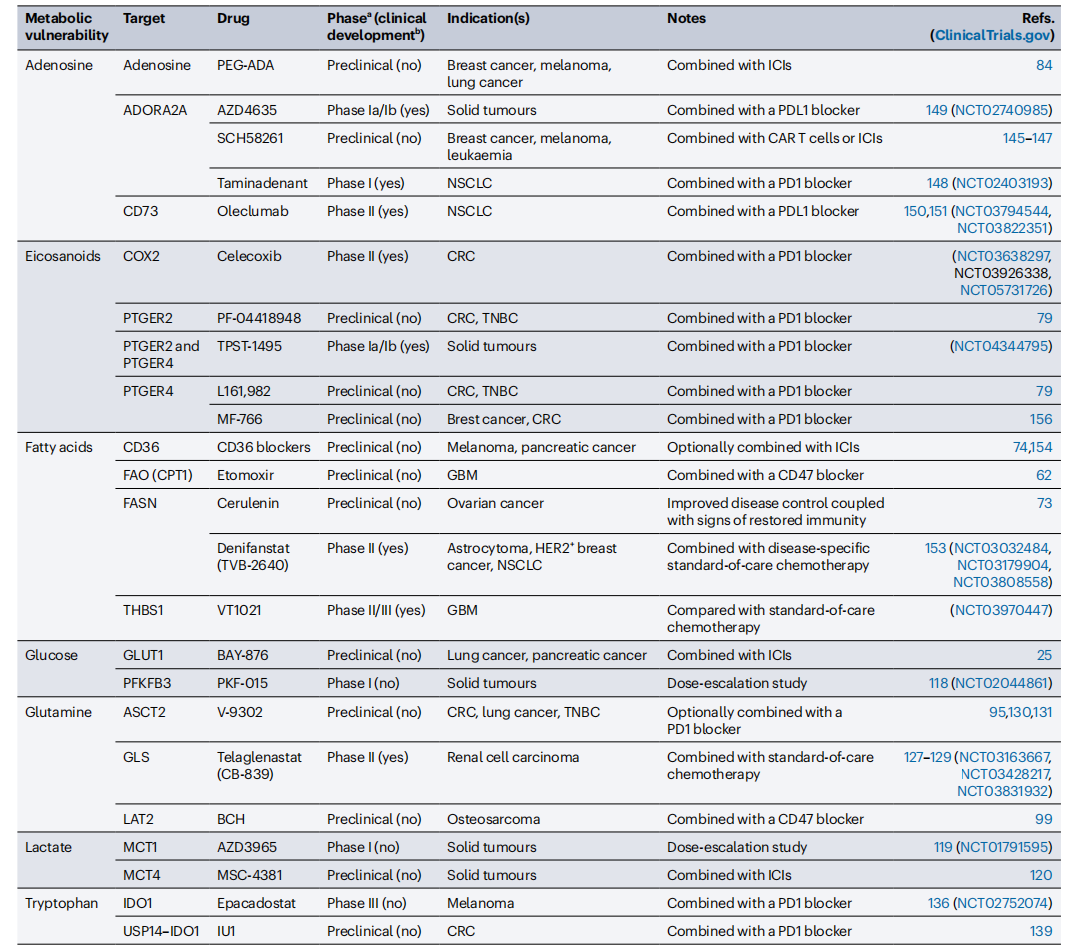
表1 靶向癌细胞以恢复免疫监视的代谢抑制剂
该表仅列出了一些主要例子,并不全面。缩略语如下:ADORA2A:腺苷A2a受体;ASCT2:氨基酸转运体;BCH:2-氨基二环-(2,2,1)-庚烷-2-羧酸;CAR:嵌合抗原受体;COX2:环氧化酶2;CPT1:肉碱棕榈酰转移酶1;CRC:结直肠癌;FAO:脂肪酸氧化;FASN:脂肪酸合成酶;GBM:胶质母细胞瘤;GLS:谷氨酰胺酶;GLUT1:葡萄糖转运蛋白1;ICI:免疫检查点抑制剂;IDO1:吲哚胺2,3-双加氧酶1;LAT2:氨基酸转运体;MCT:单羧酸转运体;NSCLC:非小细胞肺癌;PEG-ADA:聚乙二醇化腺苷脱氨酶;PFKFB3:6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3;PTGER2:前列腺素E受体2;THBS1:血小板反应蛋白1;TNBC:三阴性乳腺癌;USP14:泛素特异性肽酶14。重要说明:a. 最先进的临床试验阶段;b. 根据ClinicalTrials.gov,截至2024年2月。此表格展示了针对癌细胞代谢以恢复免疫监视的主要代谢抑制剂及其相关临床试验信息。
6.1 葡萄糖和乳酸
在胰腺癌和肺癌的临床前模型中,药物Bay876对GLUT1进行抑制,已被证明可以增强对PD1靶向免疫检查点抑制剂(ICI)的治疗反应。然而,GLUT3(也称为SLC2A3)的过表达似乎部分代偿了GLUT1的抑制,这提示联合抑制GLUT1和GLUT3可能是更有效的策略。在黑色素瘤和结直肠癌的小鼠模型中,PD1阻断与PKF-015(糖酵解酶6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3 [PFKFB3] 的药物抑制剂)有协同作用,这一效应可能是由于PFKFB3抑制导致PDL1表达增加。在实体瘤患者中测试PKF-015类似物的I期临床试验初步结果证实了这一方法在人体中的可行性。
尽管如此,靶向葡萄糖摄取或消耗的肿瘤治疗仍然具有挑战性,因为包括神经元在内的多种健康细胞的正常功能依赖于葡萄糖代谢,这需要开发精准的递送策略。至少从理论上讲,在肿瘤微环境中抑制乳酸分泌或摄取可能比全面阻断糖酵解更具可行性。然而,过去专注于乳酸的药物开发工作,包括MCT1抑制剂AZD3965(在晚期实体瘤患者中耐受性良好)已停止。近期的临床前研究结果表明,多种乳酸靶向策略(包括MCT4抑制剂MSC-4381)与各种免疫疗法之间存在积极的相互作用。
6.2 谷氨酰胺
据报道,GLS靶向药物Telaglenastat(也称为CB-839)与放疗联合使用可以协同治疗人头颈部鳞状细胞癌和非小细胞肺癌(NSCLC)异种移植瘤。然而,目前尚不清楚Telaglenastat的放射增敏作用是否涉及固有免疫激活。尽管如此,在免疫正常的黑色素瘤模型中,Telaglenastat被证明与CTLA4和PD1阻滞剂有协同作用,这表明该药物确实具有与治疗相关的免疫刺激作用。
转移性肾细胞癌患者的几项独立研究的临床数据表明,Telaglenastat可以安全地与标准化疗联合使用,但治疗获益较小。这些临床发现降低了将Telaglenastat作为新型抗癌药物开发的兴趣,截至2024年2月,只有一项针对NSCLC患者的研究仍在开放招募(ClinicalTrials.gov: NCT03831932)。
利用2-氨基双环-(2,2,1)-庚烷-2-羧酸(BCH)通过LAT2药理抑制谷氨酰胺摄取,已被证明可以增强免疫原性化疗药物多柔比星对骨肉瘤细胞的治疗效果,这一效应至少部分归因于CD47下调和癌细胞吞噬作用增加。同样,V-9302是一种通过溶质载体ASCT2(也称为SLC1A5)摄取谷氨酰胺的药理学抑制剂,在三阴性乳腺癌(TNBC)临床前模型中被证明能够介导T细胞依赖的肿瘤控制。
然而,V-9302在小鼠肺癌和结直肠癌细胞中也通过NF-κB上调PDL1,抑制了肿瘤靶向免疫反应。这种免疫抑制反应伴随着恶性细胞表面死亡受体FAS(也称为CD95)的上调,从而使恶性细胞对PDL1阻滞剂重新激活的T细胞应答更敏感。这些关于V-9302对抗癌免疫影响的不同观察结果是否反映了不同癌细胞类型中谷氨酰胺代谢的特异性,仍需进一步研究。
6.3 色氨酸
在一系列免疫正常的肿瘤模型中,临床前数据表明,通过药理学或遗传学方法阻断IDO1和/或TDO活性可以显著增强免疫治疗效果,并且免疫检查点抑制剂(ICIs)通常可以放大这种效果。这些发现激发了开发临床上可测试的IDO1抑制剂(如epacadostat)的极大兴趣。早期非随机临床试验的初步结果显示,在晚期实体瘤患者中,epacadostat联合PD1阻滞剂是安全且有效的。然而,尽管预期很高,在晚期黑色素瘤患者中进行的一项随机三期临床研究表明,epacadostat联合PD1阻滞剂帕博利珠单抗相比于单独使用帕博利珠单抗没有显示出显著的治疗优势。这是否反映了色氨酸替代降解途径的存在,仍有待证实。这些替代途径已被证明在非肿瘤性疾病(尤其是自身免疫性疾病)中介导免疫抑制,并可能在IDO1抑制的情况下上调。这些负面结果大大降低了制药公司对开发IDO1抑制剂的兴趣,截至2024年2月,只有少数临床试验仍在开放招募。然而,新的IDO1靶向方法,如通过抑制泛素特异性肽酶14(USP14)的IU1,已在结直肠癌(CRC)临床前模型中有效恢复了T细胞依赖的疾病控制,可能会重新激发人们的兴趣。
6.4 核苷酸
在各种临床前癌症模型中,药理学抑制CD39、CD73和/或腺苷受体与抗癌免疫恢复和疾病控制改善相关。据报道,靶向CD73的小分子AB680可以增强小鼠胰腺癌对PD1特异性免疫抑制剂的敏感性,这种治疗效果与Treg细胞在肿瘤中的减少有关。同样,在乳腺癌临床前模型中,靶向CD73的单克隆抗体可提高局部放疗联合CTLA4阻滞剂的疗效,部分原因是DC在肿瘤微环境中的增加和活化。
在三阴性乳腺癌(TNBC)、黑色素瘤和肺癌的临床前模型中,将可将细胞外腺苷转化为肌苷的聚乙二醇化腺苷脱氨酶与PD1阻滞剂联合应用也显示了类似的效果。最后,腺苷A2a受体(ADORA2A)拮抗剂在临床前肿瘤模型中已被证明与几种免疫治疗策略有协同作用,包括白血病模型中的CAR T细胞疗法以及乳腺癌和黑色素瘤模型中的PD1阻滞剂。
与这些临床前研究结果一致,多个I期临床试验在结直肠癌(CRC)、非小细胞肺癌(NSCLC)或去势抵抗性前列腺癌患者中评估了ADORA2A或ADORA2B拮抗剂,结果令人鼓舞。此外,两项平行的II期研究报告了中和CD73的单克隆抗体(oleclumab)联合PDL1阻滞剂durvalumab在可手术的NSCLC患者中作为新辅助治疗,或在不可手术的NSCLC患者中作为治疗的一部分,显示出了很有前景的活性。
相反,尽管已有大量研究评估并将继续评估CD39阻滞剂在癌症患者中的应用,但其临床适用性仍不确定。
6.5 脂肪酸
据报道,CPT1阻断剂Etomoxir与CD47靶向抗体和放疗联合使用,可以协同对抗在颅内建立的放射抗性小鼠胶质母细胞瘤(GBM),并与巨噬细胞依赖的癌细胞吞噬功能恢复有关。然而,目前尚不清楚这些发现是否可以转化为人类GBM。在卵巢癌的临床前模型中,药物浅蓝菌素对FASN进行抑制,被证明可以通过效应T细胞恢复DC的活化和肿瘤浸润,这与部分肿瘤控制相关。与这些发现一致,FASN抑制剂Denifanstat(也称为TCB-2640)在晚期肿瘤和高级别星形细胞瘤患者中具有良好的耐受性,这促使我们启动了多项临床试验(ClinicalTrials.gov: NCT02980029、NCT03179904、NCT03808558、NCT05743621)。在胰腺癌和黑色素瘤的临床前模型中,CD36阻断剂与免疫原性免疫疗法联合使用也显示出前景,但将CD36阻断剂开发为临床可用药物的过程仍处于初级阶段。目前只有一种药物(VT1021)——靶向CD36配体血小板反应蛋白1(THBS1)——正在评估其用于GBM的治疗(ClinicalTrials.gov: NCT03970447)。
6.6 二十烷类
与PGE2有效抑制抗癌免疫反应的能力一致,抑制COX2、PTGER2和/或PTGER4的药理学策略在多种临床前肿瘤模型(包括CRC、黑色素瘤、乳腺癌和NSCLC模型)中改善了肿瘤控制,恢复了免疫效应功能,并与免疫检查点抑制剂(ICI)产生了协同效应。由于肝X受体(LXR)激动剂被证明可以促进MFSD2A(内源性COX2抑制剂)的表达,这些药物可能是限制COX2依赖性免疫抑制的有前景的工具。然而,最近的证据表明,LXR激活也可导致鞘磷脂磷酸二酯酶样3A的表达,至少在髓系细胞中,这种酶可主动降解cGAS产物2′,3′-环GMP-AMP,从而抑制STING1激活下游的I型干扰素生成。类似地,包括塞来昔布和阿司匹林在内的传统COX2抑制剂也具有一系列免疫抑制作用,包括直接抑制cGAS。因此,通过PGE2导向策略恢复最佳抗癌免疫可能更适合拮抗PGE2受体的药物(如PTGER2和PTGER4),而不是靶向COX2。
例如,目前正在研究TPST-1495(PTGER2和PTGER4的双重拮抗剂)单独使用或与PD1阻滞剂帕博利珠单抗联合使用,作为晚期实体瘤患者的治疗方法(ClinicalTrials.gov: NCT04344795)。关于塞来昔布联合帕博利珠单抗治疗结直肠癌或直肠癌患者的其他试验也在进行中(ClinicalTrials.gov: NCT03638297、NCT03926338、NCT05731726),这些研究主要基于COX2抑制剂在这些肿瘤类型中已证实的肿瘤预防作用。观察这些研究是否能证明COX2抑制和PD1阻滞剂之间的协同作用将是非常有趣的。
总之,这些发现强调了代谢抑制剂不仅可以作为癌症靶向药物,还可以作为免疫刺激剂,与其他治疗策略协同,从而恢复免疫监视的潜力。
7.结论和未来方向
“免疫代谢”一词指的是免疫细胞的代谢配置,这种配置是动态的,对微环境信号极其敏感,并对免疫效应功能至关重要。这一点也许并不令人惊讶。除了细胞内的代谢,肿瘤浸润的免疫细胞还受到恶性转化和肿瘤进展伴随的代谢改变的影响,正如本文所讨论的。重要的是,虽然多种临床相关药物已被证明具有免疫刺激效应,但癌细胞代谢改变对免疫刺激的潜在贡献常常被忽视。
越来越多的临床前研究表明,靶向癌细胞代谢可以实现免疫刺激效应,而各种形式的免疫疗法(尤其是免疫检查点抑制剂)可以最大化这些免疫刺激效应。然而,这一范式的临床转化面临多重挑战。首先,迄今为止开发的大多数代谢调节剂对癌细胞的特异性有限,因此它们可能对健康组织有毒性和/或直接损害免疫功能。这就需要开发将代谢抑制剂靶向递送到恶性细胞的策略,例如使用含药脂质体,这些脂质体表达一种或多种癌细胞受体配体,或者使用具有促进癌细胞选择性摄取的物理化学特征的药物相关纳米粒子。
其次,虽然现代组学技术可用于研究诊断性活检中的代谢缺陷,但临床癌症治疗中常用的几种疗法会产生显著的代谢后果,可能直接促进恶性细胞的代谢重组,或间接选择具有特定代谢特征的肿瘤细胞,通常在广泛的肿瘤内异质性背景下。因此,尽可能多地从治疗前和治疗后活检中获得关于常规癌症疗法带来的代谢变化及其免疫调节相关信息(例如,通过纵向监测肿瘤内代谢物)是很重要的。
第三,目前大多数临床前肿瘤模型未能再现人类肿瘤的代谢和免疫异质性。携带非分离的患者来源物质并有患者来源造血前体细胞定植的人源化小鼠可能部分绕过这一问题,但这些小鼠也有自己的局限性。最后,一些与宿主相关的因素已被证明影响癌细胞的代谢和/或免疫功能,不仅包括明显的全身性疾病,如肥胖和糖尿病,还包括一些不太容易识别的变量,如肿瘤内和肠道微生物群的丰度和组成。我们需要进一步研究这些因素、癌细胞代谢和肿瘤靶向免疫之间错综复杂的机制联系。
尽管存在这些和其他挑战,癌细胞代谢仍是恢复免疫监视的一个有希望的靶点,可以将“冷”肿瘤转化为对免疫治疗有反应的“热”病变。
术语表
合成代谢:一组代谢途径,由较小的单位构建大分子,以支持细胞生长和增殖。
自噬:一种溶酶体依赖的分解代谢途径,确保多余的、功能障碍的或潜在的细胞毒性细胞质物质的降解。
癌症相关成纤维细胞(CAFs):一群异质性的成纤维细胞,定义肿瘤间质,并与肿瘤微环境的恶性和免疫成分沟通。
分解代谢:一组代谢途径,将大分子分解成更小的单位,以便再循环或产生ATP。
巴豆酰化:巴豆酰辅酶a对赖氨酸残基的翻译后修饰。
从头脂质生物合成:将乙酰辅酶A转化为用于细胞合成代谢的长链脂质的代谢级联。
免疫检查点抑制剂(ICIs):靶向共抑制性T细胞受体的单克隆抗体,支持恢复抗癌免疫监视
乳酸化:乳酸对赖氨酸残基的翻译后修饰。
髓源性抑制细胞(MDSCs):低分化的髓系细胞,具有显著的免疫抑制和促进肿瘤的特性。
氧化磷酸化(OXPHOS):由三羧酸循环(TCA循环)提供的NADH和琥珀酸提供的线粒体途径,通过一系列氧化反应产生ATP,最终生成H2O。
磷酸戊糖途径:一种代谢分流,将糖酵解中间体转向核苷酸、某些氨基酸和抗氧化剂的合成。
T细胞耗竭:在许多慢性感染和癌症中出现的一种T细胞功能障碍状态。
三羧酸循环(TCA循环):一种线粒体回路,确保参与数种分解代谢和合成代谢反应(包括乙酰辅酶A、丙酮酸盐、草乙酸盐、琥珀酸盐和α-酮戊二酸)的关键代谢物达到足够水平。
肿瘤相关巨噬细胞(TAMs):肿瘤内巨噬细胞的异质性和可塑性群体,其活性范围从显著的抗肿瘤(m1样TAMs)到显著的促肿瘤(m2样TAMs)。将这些体外定义的M1和M2表型外推到体内时应谨慎。
尿素循环:将多余的氨转化为尿素排泄的代谢途径。

关注本号~

加入读者交流群~
(添加请备注单位姓名)

加入知识星球~
点亮赞与在看
让更多人看到
本篇文章来源于微信公众号: OncoLab
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏